Física
5ª aula
Calorimetria (I)
Borges e Nicolau
Calor
Ao misturarmos massas de água quente e água fria em um recipiente obtemos água morna. A temperatura final é consequência da interação energética entre as massas de água.
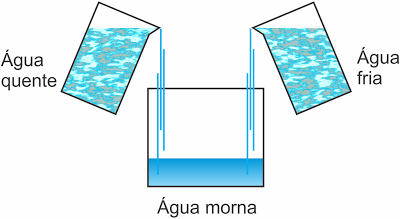
Um corpo de temperatura elevada colocado em contato com um corpo de temperatura mais baixa cede calor até que seja atingida a temperatura de equilíbrio térmico.
Calor é energia térmica em trânsito entre corpos a diferentes temperaturas.
Animação:
Calor: energia térmica em trânsito
Clique aqui
Calor sensivel
É o calor que cedido a um corpo ou retirado deste produz mudança de temperatura.
Calor latente
É o calor que cedido a um corpo ou retirado deste produz mudança de estado.
Animação:
Calor sensivel e calor latente
Clique aqui
Quantidade de calor (Q)
É a grandeza por meio da qual avalia-se a energia térmica em trânsito (calor) entre sistemas a diferentes temperaturas.
Unidade no SI: joule (J)
Unidade usual: caloria (cal)
Relação: 1 cal = 4,1868 J
Equação fundamental da calorimetria
Um corpo de massa m recebe uma quantidade de calor sensível Q e sofre uma variação de temperatura ?? = ?2 - ?1. Verifica-se, por meio de experiências, que Q é diretamente proporcional a m e à variação de temperatura ??:
c é um coeficiente de proporcionalidade que caracteriza a substância que constitui o corpo e é denominado calor específico sensível.
O calor específico (c) de uma substância mede numericamente a quantidade de calor que faz variar em 1 ºC a temperatura da massa de 1 g da substância.
Unidade usual: cal/g.ºC
Diminuição de temperatura
Capacidade térmica (C) de um corpo
Mede numericamente a quantidade de calor que faz variar de 1 ºC a temperatura do corpo.
Unidade usual: cal/ºC
O equivalente em água de um corpo é a massa de água cuja capacidade térmica é igual à do corpo.
O calorímetro é um recipiente onde costumam ser colocados os corpos em experiências de trocas de calor.
Os calorímetros devem ser isolados termicamente do ambiente e apresentar baixa capacidade térmica.
Princípio geral das trocas de calor
Se dois ou mais corpos trocam calor entre sí, a soma algébrica das quantidades de calor trocadas pelos corpos, até o estabelecimento do equilíbrio térmico, é nula.
Exercícios Básicos
Exercício 1:
A capacidade térmica de um recipiente é de 2,0.102 cal/ºC. Coloca-se no recipiente 1,0 L de água. O conjunto encontra-se inicialmente a 25 ºC. Qual é a quantidade de calor necessária para elevar a temperatura do conjunto a 50 ºC?
Dados:
calor específico da água: 1,0 cal/g.ºC
densidade da água: 1,0 g/cm3
Resolução: clique aqui
Exercício 2:
Uma fonte térmica fornece calor com potência de 30 W (W = J/s). Um bloco homogêneo, de massa 100 g, recebe calor desta fonte e sua temperatura se eleva de 20 ºC a 30 ºC durante o intervalo de tempo de 90 s. Qual é o calor específico da substância que constitui o bloco?
Resolução: clique aqui
Exercício 3:
Determine o intervalo de tempo necessário para aquecer 20 L de água de 20 ºC a
50 ºC, utilizando-se um coletor solar que fornece calor com potência média de
3,0 kW.
Dados:
calor específico da água: 1,0 cal/g.ºC
densidade da água: 1,0 g/cm3
1 cal = 4 J
Resolução: clique aqui
Exercício 4:
Dois blocos cúbicos, A e B, de mesmo material e arestas iguais a 20 cm e 10 cm, respectivamente, estão inicialmente à temperatura de 20 ºC. Os blocos são aquecidos e recebem a mesma quantidade de calor. Se o bloco A atinge a temperatura de 30 ºC, qual é a temperatura atingida pelo bloco B?
Resolução: clique aqui
Exercício 5:
Pretendendo determinar o calor específico de um líquido o professor Adalberto levou seus alunos ao laboratório do colégio e fez a seguinte experiência: aqueceu 400 g de água com uma fonte de potência constante e observou que após 5 minutos a temperatura da água sofreu uma elevação de 20 ºC. Utilizando a mesma fonte de calor, substituiu a água por 800 g do líquido cujo calor específico pretendia determinar. Constatou que após 3 minutos a temperatura do líquido aumentou de
12 ºC. Qual foi o valor encontrado para o calor específico do líquido, sabendo-se que o da água é 1,0 cal/g.ºC? Para o cálculo o professor Adalberto desprezou as perdas de calor para o meio ambiente e as capacidades térmicas dos recipientes que contêm a água e o líquido.
Resolução: clique aqui
Exercícios de Revisão
Revisão/Ex 1:
(PUC?MG)
Se ocorre troca de calor entre dois corpos, é correto dizer que, no início desse processo, são diferentes:
a) suas massas
b) suas capacidades térmicas
c) seus calores específicos
d) suas temperaturas
Resolução: clique aqui
Revisão/Ex 2:
(ULBRA?RS)
O quociente entre a quantidade de calor, ?Q, fornecida a um corpo e o correspondente acréscimo de temperatura, ??, é denominado:
a) calor específico.
b) capacidade térmica.
c) equivalente térmico.
d) lei de Joule.
e) equivalente mecânico.
Resolução: clique aqui
Revisão/Ex 3:
(Fatec-SP)
Em um sistema isolado, dois objetos, um de alumínio e outro de cobre, estão à mesma temperatura. Os dois são colocados simultaneamente sobre uma chapa quente e recebem a mesma quantidade de calor por segundo. Após certo tempo, verifica-se que a temperatura do objeto de alumínio é igual à do objeto de cobre, e ambos não mudaram de estado. Se o calor específico do alumínio e do cobre valem respectivamente, 0,22 cal/g.ºC e 0,09 cal/g.ºC, pode-se afirmar que
a) a capacidade térmica do objeto de alumínio é igual à do objeto de cobre.
b) a capacidade térmica do objeto de alumínio é maior que a do objeto de cobre.
c) a capacidade térmica do objeto de alumínio é menor que a do objeto de cobre.
d) a massa do objeto de alumínio é igual à massa do objeto de cobre.
e) a massa do objeto de alumínio é maior que a massa do objeto de cobre.
Resolução: clique aqui
Revisão/Ex 4:
(FURG?RS)
Dois blocos de mesma massa, um de cobre e outro de chumbo, inicialmente a 20 ºC, são aquecidos por chamas idênticas. Após um determinado tempo de aquecimento, constata-se que o bloco de cobre atinge a temperatura de 120 ºC, enquanto o de chumbo chega a 320 ºC. Essa diferença nas temperaturas finais ocorre porque o cobre apresenta maior:
a) calor específico.
b) massa.
c) densidade.
d) temperatura inicial.
e) coeficiente de dilatação
Resolução: clique aqui
Revisão/Ex 5:
(Mackenzie-SP)
Certo estudante, em um laboratório de Física, na Inglaterra, realizou uma experiência que envolvia trocas de calor. Durante uma parte do trabalho, teve de aquecer um corpo de massa 1,00 kg, constituído de uma liga de alumínio, cujo calor específico é c = 0,215 cal/(g.ºC). A temperatura do corpo variou de 212 ºF até 392 ºF.
Considerando que 1 caloria = 4,2 J, a energia térmica recebida por esse corpo foi aproximadamente
a) 160 kJ
b) 90 kJ
c) 40 kJ
d) 16 kJ
e) 9 kJ
Resolução: clique aqui
- Cursos Do Blog - Termologia, Óptica E Ondas
Desde a Antiguidade o fogo é a fonte de calor predominantemente utilizada pelo homem 5ª aula Calorimetria (I) Borges e Nicolau Calor Ao misturarmos massas de água quente e água fria em um recipiente obtemos água morna. A temperatura final é consequência...
- Cursos Do Blog - Termologia, Óptica E Ondas
Calorimetria (II) Borges e Nicolau Vamos recordar a aula da semana passada. Equação fundamental da calorimetria Um corpo de massa m recebe uma quantidade de calor sensível Q e sofre uma variação de temperatura ?? = ?2 - ?1. Verifica-se, por meio...
- Cursos Do Blog - Termologia, Óptica E Ondas
Calorimetria (I) Borges e Nicolau Calor Ao misturarmos massas de água quente e água fria em um recipiente obtemos água morna. A temperatura final é consequência da interação energética entre as massas de água. Um corpo de temperatura elevada...
- Cursos Do Blog - Respostas 15/03
Calorimetria (I) Borges e Nicolau Exercício 1: A capacidade térmica de um recipiente é de 2,0.102 cal/ºC. Coloca-se no recipiente 1,0 L de água. O conjunto encontra-se inicialmente a 25 ºC. Qual é a quantidade de calor necessária para elevar...
- Cursos Do Blog - Termologia, Óptica E Ondas
Calorimetria (I) Borges e Nicolau Calor Ao misturarmos massas de água quente e água fria em um recipiente obtemos água morna. A temperatura final é consequência da interação energética entre as massas de água. Clique para ampliar Um corpo...
Física
Cursos do Blog - Termologia, Óptica e Ondas
5ª aula
Calorimetria (I)
Borges e Nicolau
Calor
Ao misturarmos massas de água quente e água fria em um recipiente obtemos água morna. A temperatura final é consequência da interação energética entre as massas de água.

Um corpo de temperatura elevada colocado em contato com um corpo de temperatura mais baixa cede calor até que seja atingida a temperatura de equilíbrio térmico.
Calor é energia térmica em trânsito entre corpos a diferentes temperaturas.
Animação:
Calor: energia térmica em trânsito
Clique aqui
Calor sensivel
É o calor que cedido a um corpo ou retirado deste produz mudança de temperatura.
Calor latente
É o calor que cedido a um corpo ou retirado deste produz mudança de estado.
Animação:
Calor sensivel e calor latente
Clique aqui
Quantidade de calor (Q)
É a grandeza por meio da qual avalia-se a energia térmica em trânsito (calor) entre sistemas a diferentes temperaturas.
Unidade no SI: joule (J)
Unidade usual: caloria (cal)
Relação: 1 cal = 4,1868 J
Equação fundamental da calorimetria
Um corpo de massa m recebe uma quantidade de calor sensível Q e sofre uma variação de temperatura ?? = ?2 - ?1. Verifica-se, por meio de experiências, que Q é diretamente proporcional a m e à variação de temperatura ??:
Q = m.c.??
c é um coeficiente de proporcionalidade que caracteriza a substância que constitui o corpo e é denominado calor específico sensível.
O calor específico (c) de uma substância mede numericamente a quantidade de calor que faz variar em 1 ºC a temperatura da massa de 1 g da substância.
Unidade usual: cal/g.ºC
x?? = ?2 ? ?1
Aumento de temperatura
?2 > ?1 => ?? > 0 => Q > 0: calor recebido
Diminuição de temperatura
?2 < ?1 => ?? < 0 => Q < 0: calor cedido
Capacidade térmica (C) de um corpo
Mede numericamente a quantidade de calor que faz variar de 1 ºC a temperatura do corpo.
C = Q/?? ou C = m.c
Unidade usual: cal/ºC
O equivalente em água de um corpo é a massa de água cuja capacidade térmica é igual à do corpo.
O calorímetro é um recipiente onde costumam ser colocados os corpos em experiências de trocas de calor.
Os calorímetros devem ser isolados termicamente do ambiente e apresentar baixa capacidade térmica.
Princípio geral das trocas de calor
Se dois ou mais corpos trocam calor entre sí, a soma algébrica das quantidades de calor trocadas pelos corpos, até o estabelecimento do equilíbrio térmico, é nula.
QA + QB + QC +... = 0
Exercícios Básicos
Exercício 1:
A capacidade térmica de um recipiente é de 2,0.102 cal/ºC. Coloca-se no recipiente 1,0 L de água. O conjunto encontra-se inicialmente a 25 ºC. Qual é a quantidade de calor necessária para elevar a temperatura do conjunto a 50 ºC?
Dados:
calor específico da água: 1,0 cal/g.ºC
densidade da água: 1,0 g/cm3
Resolução: clique aqui
Exercício 2:
Uma fonte térmica fornece calor com potência de 30 W (W = J/s). Um bloco homogêneo, de massa 100 g, recebe calor desta fonte e sua temperatura se eleva de 20 ºC a 30 ºC durante o intervalo de tempo de 90 s. Qual é o calor específico da substância que constitui o bloco?
Resolução: clique aqui
Exercício 3:
Determine o intervalo de tempo necessário para aquecer 20 L de água de 20 ºC a
50 ºC, utilizando-se um coletor solar que fornece calor com potência média de
3,0 kW.
Dados:
calor específico da água: 1,0 cal/g.ºC
densidade da água: 1,0 g/cm3
1 cal = 4 J
Resolução: clique aqui
Exercício 4:
Dois blocos cúbicos, A e B, de mesmo material e arestas iguais a 20 cm e 10 cm, respectivamente, estão inicialmente à temperatura de 20 ºC. Os blocos são aquecidos e recebem a mesma quantidade de calor. Se o bloco A atinge a temperatura de 30 ºC, qual é a temperatura atingida pelo bloco B?
Resolução: clique aqui
Exercício 5:
Pretendendo determinar o calor específico de um líquido o professor Adalberto levou seus alunos ao laboratório do colégio e fez a seguinte experiência: aqueceu 400 g de água com uma fonte de potência constante e observou que após 5 minutos a temperatura da água sofreu uma elevação de 20 ºC. Utilizando a mesma fonte de calor, substituiu a água por 800 g do líquido cujo calor específico pretendia determinar. Constatou que após 3 minutos a temperatura do líquido aumentou de
12 ºC. Qual foi o valor encontrado para o calor específico do líquido, sabendo-se que o da água é 1,0 cal/g.ºC? Para o cálculo o professor Adalberto desprezou as perdas de calor para o meio ambiente e as capacidades térmicas dos recipientes que contêm a água e o líquido.
Resolução: clique aqui
Exercícios de Revisão
Revisão/Ex 1:
(PUC?MG)
Se ocorre troca de calor entre dois corpos, é correto dizer que, no início desse processo, são diferentes:
a) suas massas
b) suas capacidades térmicas
c) seus calores específicos
d) suas temperaturas
Resolução: clique aqui
Revisão/Ex 2:
(ULBRA?RS)
O quociente entre a quantidade de calor, ?Q, fornecida a um corpo e o correspondente acréscimo de temperatura, ??, é denominado:
a) calor específico.
b) capacidade térmica.
c) equivalente térmico.
d) lei de Joule.
e) equivalente mecânico.
Resolução: clique aqui
Revisão/Ex 3:
(Fatec-SP)
Em um sistema isolado, dois objetos, um de alumínio e outro de cobre, estão à mesma temperatura. Os dois são colocados simultaneamente sobre uma chapa quente e recebem a mesma quantidade de calor por segundo. Após certo tempo, verifica-se que a temperatura do objeto de alumínio é igual à do objeto de cobre, e ambos não mudaram de estado. Se o calor específico do alumínio e do cobre valem respectivamente, 0,22 cal/g.ºC e 0,09 cal/g.ºC, pode-se afirmar que
a) a capacidade térmica do objeto de alumínio é igual à do objeto de cobre.
b) a capacidade térmica do objeto de alumínio é maior que a do objeto de cobre.
c) a capacidade térmica do objeto de alumínio é menor que a do objeto de cobre.
d) a massa do objeto de alumínio é igual à massa do objeto de cobre.
e) a massa do objeto de alumínio é maior que a massa do objeto de cobre.
Resolução: clique aqui
Revisão/Ex 4:
(FURG?RS)
Dois blocos de mesma massa, um de cobre e outro de chumbo, inicialmente a 20 ºC, são aquecidos por chamas idênticas. Após um determinado tempo de aquecimento, constata-se que o bloco de cobre atinge a temperatura de 120 ºC, enquanto o de chumbo chega a 320 ºC. Essa diferença nas temperaturas finais ocorre porque o cobre apresenta maior:
a) calor específico.
b) massa.
c) densidade.
d) temperatura inicial.
e) coeficiente de dilatação
Resolução: clique aqui
Revisão/Ex 5:
(Mackenzie-SP)
Certo estudante, em um laboratório de Física, na Inglaterra, realizou uma experiência que envolvia trocas de calor. Durante uma parte do trabalho, teve de aquecer um corpo de massa 1,00 kg, constituído de uma liga de alumínio, cujo calor específico é c = 0,215 cal/(g.ºC). A temperatura do corpo variou de 212 ºF até 392 ºF.
Considerando que 1 caloria = 4,2 J, a energia térmica recebida por esse corpo foi aproximadamente
a) 160 kJ
b) 90 kJ
c) 40 kJ
d) 16 kJ
e) 9 kJ
Resolução: clique aqui
loading...
- Cursos Do Blog - Termologia, Óptica E Ondas
Desde a Antiguidade o fogo é a fonte de calor predominantemente utilizada pelo homem 5ª aula Calorimetria (I) Borges e Nicolau Calor Ao misturarmos massas de água quente e água fria em um recipiente obtemos água morna. A temperatura final é consequência...
- Cursos Do Blog - Termologia, Óptica E Ondas
Calorimetria (II) Borges e Nicolau Vamos recordar a aula da semana passada. Equação fundamental da calorimetria Um corpo de massa m recebe uma quantidade de calor sensível Q e sofre uma variação de temperatura ?? = ?2 - ?1. Verifica-se, por meio...
- Cursos Do Blog - Termologia, Óptica E Ondas
Calorimetria (I) Borges e Nicolau Calor Ao misturarmos massas de água quente e água fria em um recipiente obtemos água morna. A temperatura final é consequência da interação energética entre as massas de água. Um corpo de temperatura elevada...
- Cursos Do Blog - Respostas 15/03
Calorimetria (I) Borges e Nicolau Exercício 1: A capacidade térmica de um recipiente é de 2,0.102 cal/ºC. Coloca-se no recipiente 1,0 L de água. O conjunto encontra-se inicialmente a 25 ºC. Qual é a quantidade de calor necessária para elevar...
- Cursos Do Blog - Termologia, Óptica E Ondas
Calorimetria (I) Borges e Nicolau Calor Ao misturarmos massas de água quente e água fria em um recipiente obtemos água morna. A temperatura final é consequência da interação energética entre as massas de água. Clique para ampliar Um corpo...
