Física
Termodinâmica (IV)
Borges e Nicolau
1. Transformação isobárica
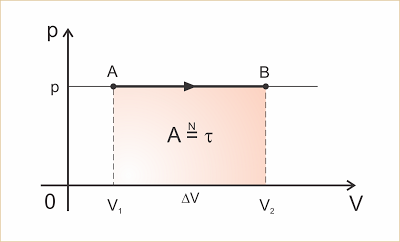
Na transformação isobárica estudamos que o trabalho ? que o gás realiza sobre o meio exterior ou recebe do meio exterior é dado pelo produto da pressão p pela variação de volume ?V:
Estudamos também que este trabalho é numericamente igual à área do retângulo no gráfico p x V.
Seja massa m a massa, n o número de mols e ?T a variação de temperatura de um gás que sofre uma transformação isobárica. A quantidade de calor que o gás troca com o meio exterior pode ser calculada de uma das seguintes maneiras:
x
cP e CP são, respectivamente, o calor específico a pressão constante e o calor molar a pressão constante do gás. Observe que: CP = cP . M, onde M é a massa molar do gás.
2. Transformação isocórica
Na transformação isocórica sabemos que o trabalho trocado pelo gás é nulo:
Seja massa m a massa, n o número de mols e ?T a variação de temperatura de um gás que sofre uma transformação isocórica. A quantidade de calor que o gás troca com o meio exterior pode ser calculada de uma das seguintes maneiras:
cV e CV são, respectivamente, o calor específico a volume constante e o calor molar a volume constante do gás. Observe que: CV = cV . M, onde M é a massa molar do gás.
3. Relação de Mayer
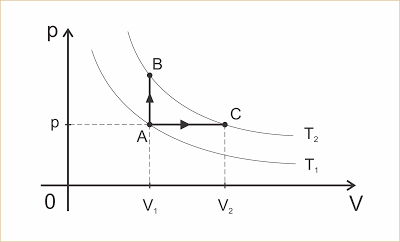
No diagrama p x V as curvas representam duas transformações isotérmicas nas temperaturas T1 e T2, com T1 < T2. Vamos considerar que um gás perfeito com n mols sofra uma das transformações A => B ou A => C.
Na transformação A => B (isocórica), temos: ? = 0 e pela Primeira Lei da Termodinâmica (Q = ? + ?U), vem: QV = ?UV (1)
Na transformação A => C (isobárica), temos pela Primeira Lei
da Termodinâmica: QP = ?P + ?UP (2).
Mas ?UV = ?UP pois as duas transformações sofrem a mesma variação de temperatura. Assim, de (1) e (2), resulta:
QP = ?P + QV => QP - QV = ?P => n.CP.?T - n.CV.?t = p.?V =>
n.CP.?T - n.CV.?T = n.R.?T =>
4. Revisando a Segunda lei da Termodinâmica
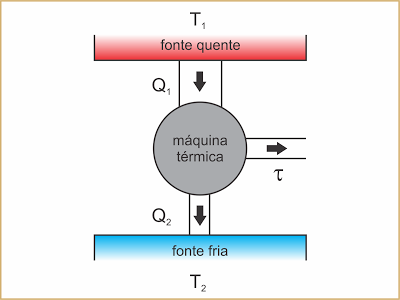
Na conversão de calor em trabalho de modo contínuo, a máquina deve operar em ciclos entre duas fontes térmicas, uma fonte quente e uma fonte fria. Em cada ciclo, a máquina retira uma quantidade de calor Q1 da fonte quente, que é parcialmente convertida em trabalho ?, e rejeita para a fonte fria a quantidade de calor Q2 que não foi convertida.
Esquematicamente:
Exemplo: o motor a explosão de um automóvel.
A fonte quente corresponde à câmara de combustão onde a faísca da vela inflama o vapor do combustível. Em cada ciclo, é produzida uma quantidade de calor Q1 a uma temperatura elevada (T1). Parte dessa energia se converte no trabalho ?, que é a energia útil que move o veículo. A quantidade de calor Q2, que não se converteu, é rejeitada para a fonte fria (o ar atmosférico), que se mantém numa temperatura relativamente mais baixa (T2).
Funcionamento do motor a explosão. Clique aqui x
Rendimento ? de uma máquina térmica
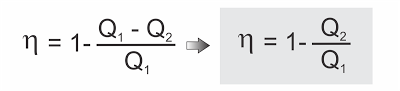
É o quociente entre a energia útil obtida em cada ciclo (o trabalho ?) e a energia total fornecida pela fonte quente (a quantidade de calor Q1).
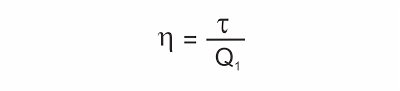
Sendo ? = Q1 - Q2, resulta:
Ciclo de Carnot
É um ciclo teórico constituído por duas transformações isotérmicas nas temperaturas T1 e T2, respectivamente das fontes quente e fria, alternadas com duas transformações adiabáticas.
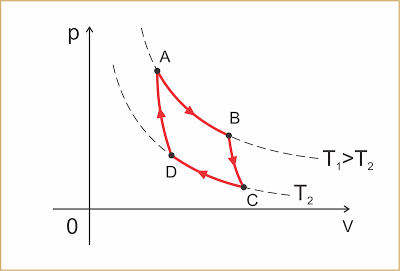
AB: expansão isotérmica à temperatura T1 (fonte quente). Nesta transformação o gás recebe a quantidade de calor Q1
BC: é a expansão adiabática, na qual a temperatura diminui para T2
CD: compressão isotérmica à temperatura T2 (fonte fria). Nesta transformação o gás cede a quantidade de calor Q2
DA: compressão adiabática na qual a temperatura aumenta para T1.
O trabalho obtido por ciclo corresponde à área interna dele.
No ciclo de Carnot a relação Q2/Q1 é igual a T2/T1. Assim, o rendimento de uma máquina térmica operando com o ciclo de Carnot é dado por:
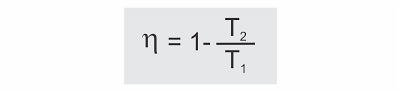
Importante: o máximo rendimento teoricamente possível de uma máquina térmica funcionando entre as duas temperaturas T1 e T2, das fontes quente e fria, é quando opera segundo o ciclo de Carnot.
Exercícios básicos
Exercício 1:
Um gás perfeito sofre uma transformação A => B por um dos dois caminhos indicados no diagrama abaixo. Sejam ?I o trabalho trocado na transformação
I e ?II o trabalho trocado na transformação II.
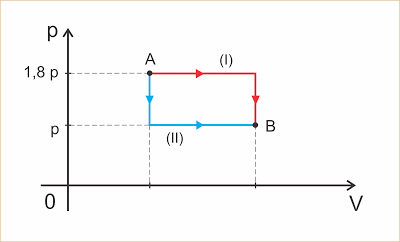
Pode-se afirmar que:
a) ?I = ?II
b) ?I > ?II
c) ?I < ?II
d) ?I = 2.?II
e) ?I = 0,5.?II
Resolução: clique aqui
Exercício 2:
Retome a questão anterior. Sejam ?UI a variação de energia interna na transformação I e ?UII a variação de energia interna na transformação II. Pode-se afirmar que:
a) ?UI = ?UII
b) ?UI > ?UII
c) ?UI < ?UII
d) ?UI = 2.?UII
e) ?UI = 0,5.?UII
Resolução: clique aqui
Exercício 3:
A massa de 30 g de hélio (massa molar M = 4 g/mol), considerado um gás ideal, dilata-se isobaricamente. Sendo R = 2 cal/mol.K a constante universal dos gases perfeitos, cV = 0,75 cal/g.K o calor específico do hélio sob volume constante. Determine a quantidade de calor que o gás recebe no processo sabendo-se que sua temperatura varia de 200 K a 600 K.
Resolução: clique aqui
Exercício 4:
Admita que o aquecimento do mesmo gás do exercício anterior (de 200 K para 600 K) tivesse sido realizado isocoricamente. Determine para essa situação a quantidade de calor recebida pelo gás.
Resolução: clique aqui
Exercício 5:
As máquinas térmicas transformam a energia interna de um combustível em energia mecânica. De acordo com a 2ª Lei da Termodinâmica, não é possível construir uma máquina térmica que transforme toda a energia interna do combustível em trabalho, isto é, uma máquina de rendimento igual a 1 ou equivalente a 100%. O cientista francês Sadi Carnot (1796-1832) provou que o rendimento máximo obtido por uma máquina térmica operando entre as temperaturas T1 (fonte quente) e T2 (fonte fria) é dado por:
a) entre duas fontes à mesma temperatura, T1 = T2, no zero absoluto.
b) entre uma fonte quente a uma temperatura, T1, e uma fonte fria a uma temperatura T2 = 0 ºC.
c) entre duas fontes à mesma temperatura, T1 = T2, diferente do zero absoluto.
d) entre uma fonte quente a uma temperatura, T1, e uma fonte fria a uma temperatura T2 = 0 K. (UFRN)
Resolução: clique aqui
- Cursos Do Blog - Termologia, Óptica E Ondas
Refrigerador comum (Fontes: Física-Ciência e Tecnologia e Os fundamentos da Física) 19ª aula Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que...
- Cursos Do Blog - Termologia, Óptica E Ondas
Refrigerador comum (Fontes: Física-Ciência e Tecnologia e Os fundamentos da Física) 19ª aula Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que...
- Cursos Do Blog - Termologia, Óptica E Ondas
19ª aula Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que o gás realiza sobre o meio exterior ou recebe do meio exterior é dado pelo...
- Cursos Do Blog - Termologia, Óptica E Ondas
Termodinâmica (III) Borges e Nicolau Resumo das aulas anteriores: Segunda Lei da Termodinâmica Considere, por exemplo, um gás sofrendo uma expansão isotérmica AB. Clique para ampliar Nesta transformação a variação de energia interna...
- Cursos Do Blog - Termologia, Óptica E Ondas
Termodinâmica (III) Borges e Nicolau Resumo das aulas anteriores: Segunda Lei da Termodinâmica Considere, por exemplo, um gás sofrendo uma expansão isotérmica AB. Clique para ampliar Nesta transformação a variação de energia interna...
Física
Cursos do Blog - Termologia, Óptica e Ondas
Termodinâmica (IV)
Borges e Nicolau
Revisando e complementando
1. Transformação isobárica
Na transformação isobárica estudamos que o trabalho ? que o gás realiza sobre o meio exterior ou recebe do meio exterior é dado pelo produto da pressão p pela variação de volume ?V:
? = p . ?V
Estudamos também que este trabalho é numericamente igual à área do retângulo no gráfico p x V.

Clique para ampliar
Seja massa m a massa, n o número de mols e ?T a variação de temperatura de um gás que sofre uma transformação isobárica. A quantidade de calor que o gás troca com o meio exterior pode ser calculada de uma das seguintes maneiras:
x
Q = m . cP . ?T xex Q = n . CP . ?T
cP e CP são, respectivamente, o calor específico a pressão constante e o calor molar a pressão constante do gás. Observe que: CP = cP . M, onde M é a massa molar do gás.
2. Transformação isocórica
Na transformação isocórica sabemos que o trabalho trocado pelo gás é nulo:
? = 0
Seja massa m a massa, n o número de mols e ?T a variação de temperatura de um gás que sofre uma transformação isocórica. A quantidade de calor que o gás troca com o meio exterior pode ser calculada de uma das seguintes maneiras:
Q = m . cV . ?T xex Q = n . CV . ?T
cV e CV são, respectivamente, o calor específico a volume constante e o calor molar a volume constante do gás. Observe que: CV = cV . M, onde M é a massa molar do gás.
3. Relação de Mayer
No diagrama p x V as curvas representam duas transformações isotérmicas nas temperaturas T1 e T2, com T1 < T2. Vamos considerar que um gás perfeito com n mols sofra uma das transformações A => B ou A => C.

Clique para ampliar
Na transformação A => B (isocórica), temos: ? = 0 e pela Primeira Lei da Termodinâmica (Q = ? + ?U), vem: QV = ?UV (1)
Na transformação A => C (isobárica), temos pela Primeira Lei
da Termodinâmica: QP = ?P + ?UP (2).
Mas ?UV = ?UP pois as duas transformações sofrem a mesma variação de temperatura. Assim, de (1) e (2), resulta:
QP = ?P + QV => QP - QV = ?P => n.CP.?T - n.CV.?t = p.?V =>
n.CP.?T - n.CV.?T = n.R.?T =>
CP - CV = R
Relação de Mayer
4. Revisando a Segunda lei da Termodinâmica
"É impossível construir uma máquina, operando em ciclos, tendo como único efeito retirar calor de uma fonte e convertê-lo integralmente em trabalho".Nicolas Leonard Sadi Carnot evidenciou que para uma máquina térmica funcionar era fundamental a existência de uma diferença de temperatura. Ele estabeleceu que:
Na conversão de calor em trabalho de modo contínuo, a máquina deve operar em ciclos entre duas fontes térmicas, uma fonte quente e uma fonte fria. Em cada ciclo, a máquina retira uma quantidade de calor Q1 da fonte quente, que é parcialmente convertida em trabalho ?, e rejeita para a fonte fria a quantidade de calor Q2 que não foi convertida.
Esquematicamente:

Clique para ampliar
Exemplo: o motor a explosão de um automóvel.
A fonte quente corresponde à câmara de combustão onde a faísca da vela inflama o vapor do combustível. Em cada ciclo, é produzida uma quantidade de calor Q1 a uma temperatura elevada (T1). Parte dessa energia se converte no trabalho ?, que é a energia útil que move o veículo. A quantidade de calor Q2, que não se converteu, é rejeitada para a fonte fria (o ar atmosférico), que se mantém numa temperatura relativamente mais baixa (T2).
Funcionamento do motor a explosão. Clique aqui x
Rendimento ? de uma máquina térmica
É o quociente entre a energia útil obtida em cada ciclo (o trabalho ?) e a energia total fornecida pela fonte quente (a quantidade de calor Q1).
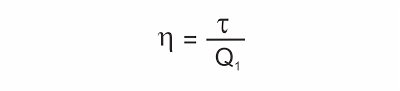
Sendo ? = Q1 - Q2, resulta:

Ciclo de Carnot
É um ciclo teórico constituído por duas transformações isotérmicas nas temperaturas T1 e T2, respectivamente das fontes quente e fria, alternadas com duas transformações adiabáticas.

Clique para ampliar
AB: expansão isotérmica à temperatura T1 (fonte quente). Nesta transformação o gás recebe a quantidade de calor Q1
BC: é a expansão adiabática, na qual a temperatura diminui para T2
CD: compressão isotérmica à temperatura T2 (fonte fria). Nesta transformação o gás cede a quantidade de calor Q2
DA: compressão adiabática na qual a temperatura aumenta para T1.
O trabalho obtido por ciclo corresponde à área interna dele.
No ciclo de Carnot a relação Q2/Q1 é igual a T2/T1. Assim, o rendimento de uma máquina térmica operando com o ciclo de Carnot é dado por:
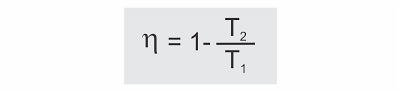
Importante: o máximo rendimento teoricamente possível de uma máquina térmica funcionando entre as duas temperaturas T1 e T2, das fontes quente e fria, é quando opera segundo o ciclo de Carnot.
Exercícios básicos
Exercício 1:
Um gás perfeito sofre uma transformação A => B por um dos dois caminhos indicados no diagrama abaixo. Sejam ?I o trabalho trocado na transformação
I e ?II o trabalho trocado na transformação II.

Clique para ampliar
Pode-se afirmar que:
a) ?I = ?II
b) ?I > ?II
c) ?I < ?II
d) ?I = 2.?II
e) ?I = 0,5.?II
Resolução: clique aqui
Exercício 2:
Retome a questão anterior. Sejam ?UI a variação de energia interna na transformação I e ?UII a variação de energia interna na transformação II. Pode-se afirmar que:
a) ?UI = ?UII
b) ?UI > ?UII
c) ?UI < ?UII
d) ?UI = 2.?UII
e) ?UI = 0,5.?UII
Resolução: clique aqui
Exercício 3:
A massa de 30 g de hélio (massa molar M = 4 g/mol), considerado um gás ideal, dilata-se isobaricamente. Sendo R = 2 cal/mol.K a constante universal dos gases perfeitos, cV = 0,75 cal/g.K o calor específico do hélio sob volume constante. Determine a quantidade de calor que o gás recebe no processo sabendo-se que sua temperatura varia de 200 K a 600 K.
Resolução: clique aqui
Exercício 4:
Admita que o aquecimento do mesmo gás do exercício anterior (de 200 K para 600 K) tivesse sido realizado isocoricamente. Determine para essa situação a quantidade de calor recebida pelo gás.
Resolução: clique aqui
Exercício 5:
As máquinas térmicas transformam a energia interna de um combustível em energia mecânica. De acordo com a 2ª Lei da Termodinâmica, não é possível construir uma máquina térmica que transforme toda a energia interna do combustível em trabalho, isto é, uma máquina de rendimento igual a 1 ou equivalente a 100%. O cientista francês Sadi Carnot (1796-1832) provou que o rendimento máximo obtido por uma máquina térmica operando entre as temperaturas T1 (fonte quente) e T2 (fonte fria) é dado por:
? = 1 - T2/T1.
Com base nessas informações, é correto afirmar que o rendimento da máquina térmica não pode ser igual a 1 porque, para isso, ela deveria operar:
a) entre duas fontes à mesma temperatura, T1 = T2, no zero absoluto.
b) entre uma fonte quente a uma temperatura, T1, e uma fonte fria a uma temperatura T2 = 0 ºC.
c) entre duas fontes à mesma temperatura, T1 = T2, diferente do zero absoluto.
d) entre uma fonte quente a uma temperatura, T1, e uma fonte fria a uma temperatura T2 = 0 K. (UFRN)
Resolução: clique aqui
loading...
- Cursos Do Blog - Termologia, Óptica E Ondas
Refrigerador comum (Fontes: Física-Ciência e Tecnologia e Os fundamentos da Física) 19ª aula Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que...
- Cursos Do Blog - Termologia, Óptica E Ondas
Refrigerador comum (Fontes: Física-Ciência e Tecnologia e Os fundamentos da Física) 19ª aula Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que...
- Cursos Do Blog - Termologia, Óptica E Ondas
19ª aula Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que o gás realiza sobre o meio exterior ou recebe do meio exterior é dado pelo...
- Cursos Do Blog - Termologia, Óptica E Ondas
Termodinâmica (III) Borges e Nicolau Resumo das aulas anteriores: Segunda Lei da Termodinâmica Considere, por exemplo, um gás sofrendo uma expansão isotérmica AB. Clique para ampliar Nesta transformação a variação de energia interna...
- Cursos Do Blog - Termologia, Óptica E Ondas
Termodinâmica (III) Borges e Nicolau Resumo das aulas anteriores: Segunda Lei da Termodinâmica Considere, por exemplo, um gás sofrendo uma expansão isotérmica AB. Clique para ampliar Nesta transformação a variação de energia interna...
