Física
Calorimetria (II)
Borges e Nicolau
Princípio geral das trocas de calor
Se dois ou mais corpos trocam calor entre sí, a soma algébrica das quantidades de calor trocadas pelos corpos, até o estabelecimento do equilíbrio térmico, é nula.
Equação fundamental da calorimetria
Em que m é a massa, c é o calor específico e ?? é a variação de temperatura.
O calor específico (c) de uma substância mede numericamente a quantidade de calor que faz variar em 1 ºC a temperatura da massa de
1 g da substância.
Unidade usual: cal/g.ºC
Exercício resolvido:
1,12.?f - 179,2 + 28.?f - 840 = 0
29,12.?f - 1019,2 = 0
?f = 35 ºC
Exercícios básicos
Exercício 1:
Num recipiente de capacidade térmica 200 cal/ºC, coloca-se 500 g de água a 20 ºC e a seguir um bloco de cobre de massa 1000 g a 100 ºC. Calcule a temperatura final de equilíbrio térmico. Admita trocas de calor apenas entre o recipiente, a água e o cobre.
Dados:
calor específico da água: 1,0 cal/g.ºC
calor específico do cobre: 0,094 cal/g.ºC
Exercício 2:
Num calorímetro de capacidade térmica 20 cal/ºC e a 20 ºC, colocam-se 40 g de água a 80 ºC. Sendo 1,0 cal/g.ºC o calor específico da água, determine a temperatura final de equilíbrio térmico.
Exercício 3:
Misturam-se massas diferentes (m1 e m2) de uma mesma substância, em temperaturas diferentes (?1 e ?2). Prove que a temperatura final ? de equilíbrio é dada por:
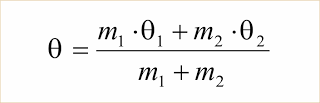
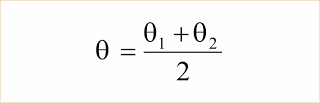
- Cursos Do Blog - Termologia, Óptica E Ondas
6ª aula Calorimetria (II) Borges e Nicolau Vamos recordar a aula da semana passada. Equação fundamental da calorimetria Um corpo de massa m recebe uma quantidade de calor sensível Q e sofre uma variação de temperatura ?? = ?2 - ?1. Verifica-se,...
- Cursos Do Blog - Termologia, Óptica E Ondas
6ª aula Calorimetria (II) Borges e Nicolau Vamos recordar a aula da semana passada. Equação fundamental da calorimetria Um corpo de massa m recebe uma quantidade de calor sensível Q e sofre uma variação de temperatura ?? = ?2 - ?1. Verifica-se,...
- Cursos Do Blog - Termologia, Óptica E Ondas
6ª aula Calorimetria (II) Borges e Nicolau Vamos recordar a aula da semana passada. Equação fundamental da calorimetria Um corpo de massa m recebe uma quantidade de calor sensível Q e sofre uma variação de temperatura ?? = ?2 - ?1. Verifica-se,...
- Cursos Do Blog - Termologia, Óptica E Ondas
Calorimetria (III) Borges e Nicolau Princípio geral das trocas de calor Se dois ou mais corpos trocam calor entre sí, a soma algébrica das quantidades de calor trocadas pelos corpos, até o estabelecimento do equilíbrio térmico, é nula. QA + QB...
- Cursos Do Blog - Respostas 22/03
Calorimetria (II) Borges e Nicolau Exercício 1: Num recipiente de capacidade térmica 200 cal/ºC, coloca-se 500 g de água a 20 0C e a seguir um bloco de cobre de massa 1000 g a 100 ºC. Calcule a temperatura final de equilíbrio térmico. Admita trocas...
Física
Cursos do Blog - Termologia, Óptica e Ondas
Calorimetria (II)
Borges e Nicolau
Princípio geral das trocas de calor
Se dois ou mais corpos trocam calor entre sí, a soma algébrica das quantidades de calor trocadas pelos corpos, até o estabelecimento do equilíbrio térmico, é nula.
QA + QB + QC +... = 0
Equação fundamental da calorimetria
Q = m.c.??
Em que m é a massa, c é o calor específico e ?? é a variação de temperatura.
O calor específico (c) de uma substância mede numericamente a quantidade de calor que faz variar em 1 ºC a temperatura da massa de
1 g da substância.
Unidade usual: cal/g.ºC
?? = ?f - ?i
Aumento de temperatura => calor recebido
?f > ?i => ?? > 0 => Q > 0
Diminuição de temperatura => calor cedido
?f < ?i => ?? < 0 => Q < 0
Exercício resolvido:

Clique para ampliar
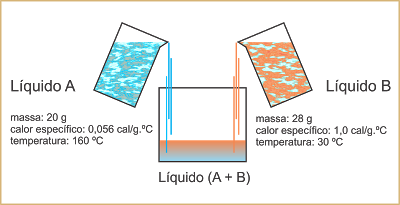
Experimento de laboratório
Um estudante misturou num calorímetro 20 g de um líquido A, de calor específico 0,056 cal/g.ºC, a 160 ºC, com 28 g de um líquido B, de calor específico 1,0 cal/g.ºC, a 30 ºC. Supondo que não houve troca de calor entre os líquidos e o calorímetro, qual foi a temperatura de equilíbrio térmico ?f registrada pelo estudante?
Resolução:
Do Princípio geral das trocas de calor:
QA + QB = 0
mA.cA.??A + mB.cB.??B = 0
20.0,056.(?f - 160) + 28.1,0.(?f - 30) = 0
1,12.(?f - 160) + 28.(?f - 30) = 01,12.?f - 179,2 + 28.?f - 840 = 0
29,12.?f - 1019,2 = 0
?f = 35 ºC
Exercícios básicos
Exercício 1:
Num recipiente de capacidade térmica 200 cal/ºC, coloca-se 500 g de água a 20 ºC e a seguir um bloco de cobre de massa 1000 g a 100 ºC. Calcule a temperatura final de equilíbrio térmico. Admita trocas de calor apenas entre o recipiente, a água e o cobre.
Dados:
calor específico da água: 1,0 cal/g.ºC
calor específico do cobre: 0,094 cal/g.ºC
Exercício 2:
Num calorímetro de capacidade térmica 20 cal/ºC e a 20 ºC, colocam-se 40 g de água a 80 ºC. Sendo 1,0 cal/g.ºC o calor específico da água, determine a temperatura final de equilíbrio térmico.
Exercício 3:
Misturam-se massas diferentes (m1 e m2) de uma mesma substância, em temperaturas diferentes (?1 e ?2). Prove que a temperatura final ? de equilíbrio é dada por:
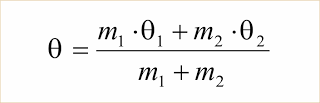
Exercício 4:
Misturam-se massas iguais (m1 = m2) de uma mesma substância, em temperaturas diferentes (?1 e ?2). Prove que a temperatura final ? de equilíbrio é dada por: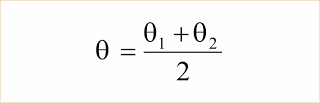
Exercício 5:
Um calorímetro contém 100 g de água, estando o conjunto à temperatura ambiente de 25 ºC. Coloca-se no calorímetro mais 100 g de água a 45 ºC. Estabelecido o equilíbrio térmico, é atingida a temperatura final de 30 ºC. Qual é a capacidade térmica do calorímetro? É dado o calor específico da água: 1,0 cal/g.ºC
loading...
- Cursos Do Blog - Termologia, Óptica E Ondas
6ª aula Calorimetria (II) Borges e Nicolau Vamos recordar a aula da semana passada. Equação fundamental da calorimetria Um corpo de massa m recebe uma quantidade de calor sensível Q e sofre uma variação de temperatura ?? = ?2 - ?1. Verifica-se,...
- Cursos Do Blog - Termologia, Óptica E Ondas
6ª aula Calorimetria (II) Borges e Nicolau Vamos recordar a aula da semana passada. Equação fundamental da calorimetria Um corpo de massa m recebe uma quantidade de calor sensível Q e sofre uma variação de temperatura ?? = ?2 - ?1. Verifica-se,...
- Cursos Do Blog - Termologia, Óptica E Ondas
6ª aula Calorimetria (II) Borges e Nicolau Vamos recordar a aula da semana passada. Equação fundamental da calorimetria Um corpo de massa m recebe uma quantidade de calor sensível Q e sofre uma variação de temperatura ?? = ?2 - ?1. Verifica-se,...
- Cursos Do Blog - Termologia, Óptica E Ondas
Calorimetria (III) Borges e Nicolau Princípio geral das trocas de calor Se dois ou mais corpos trocam calor entre sí, a soma algébrica das quantidades de calor trocadas pelos corpos, até o estabelecimento do equilíbrio térmico, é nula. QA + QB...
- Cursos Do Blog - Respostas 22/03
Calorimetria (II) Borges e Nicolau Exercício 1: Num recipiente de capacidade térmica 200 cal/ºC, coloca-se 500 g de água a 20 0C e a seguir um bloco de cobre de massa 1000 g a 100 ºC. Calcule a temperatura final de equilíbrio térmico. Admita trocas...
