Física
RESOLUÇÃO DO SIMULADO
(Questões de 21 a 30)
21. (UEMS)
Certa quantidade de gás ideal, contida num recipiente de volume 2 litros, tem uma temperatura de 27 ºC, sob uma pressão de 1,5 atm. Essa mesma quantidade de gás, se colocada num recipiente de volume 1 litro, sob uma pressão de 2 atm, terá uma temperatura de:
A) -63 ºC
B) -73 ºC
C) -83 ºC
D) -93 ºC
E) -103 ºC
Resolução:
P1.V1/T1 = P2.V2/T2 => 1,5.2/300 = 2.1/T2 =>
T2 = 200 K => -73 ºC
x
Alternativa: B
22. (UFPB)
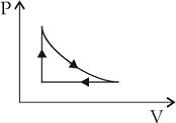
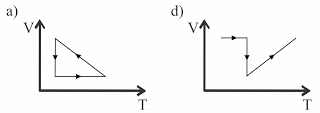
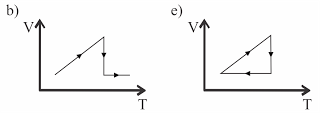
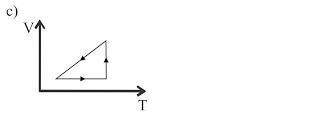
Um gás ideal sofre três processos termodinâmicos na seguinte seqüência: dilatação isotérmica, compressão isobárica e transformação isocórica. Esses processos estão representados no diagrama PV (Pressão × Volume) abaixo.
Resolução:
No diagrama V x T, temos:
dilatação isotérmica => segmento de reta paralelo ao eixo V
compressão isobárica => segmento de reta cujo prolongamento passa pela origem (0 K)
transformação isocórica => segmento de reta paralelo ao eixo T
Alternativa: C
23. (UFMA)
De acordo com a primeira Lei da Termodinâmica, a variação da energia interna (?U) igual à diferença entre o calor trocado com o ambiente (Q) e o trabalho realizado no processo termodinâmico (?). Dessa forma, qual o valor de ?U quando um gás ideal passa por transformações do tipo: isotérmica, isobárica, isométrica, adiabática e cíclica?
A) zero, Q - ?, Q, -?, zero
B) Q - ?, Q, zero, -?, zero
C) zero, Q, Q - ?, zero, -?
D) Q, -?, Q - ?, zero, zero
E) -?, Q, zero, Q - ?, zero
x
Resolução:
Transformações:
1) isotérmica: T constante, U constante e ?U = 0
2) isobárica: ?U = Q - ?
3) isométrica: V constante, ? = 0 e ?U = Q
4) adiabática: Q = 0 e ?U = -?
5) cíclica: ?U = 0
Alternativa: A
24. (UNIR-RO)
Dois gases ideais submetidos às pressões p1 = 1 atm e p2 = 2 atm, em equilíbrio térmico, estão confinados em recipientes de volumes V1 = 2 m3 e V2 = 3 m3, respectivamente, ligados por uma válvula inicialmente fechada. Ao se abrir a válvula, os dois gases fluem livremente, sem alterar sua temperatura, ocupando os dois recipientes com a mesma pressão que será:
A) 2,5 atm
B) 3,0 atm
C) 1,5 atm
D) 0,6 atm
E) 1,6 atm
x
Resolução:
O número de mols (n) da mistura dos gases depois de abrir a válvula é igual à soma dos números de mols (n1 + n2) antes de a válvula ser aberta:
n = n1 + n2
pV/RT = p1V1/RT + p2V2/RT
p.(2 + 3) = 1.2 + 2.3
p = 1,6 atm
Alternativa: E
25. (UFPE)
Um mol de um gás ideal, inicialmente à temperatura de 300 K, é submetido ao processo termodinâmico A?B?C mostrado no diagrama V versus T. Determine o trabalho realizado pelo gás, em calorias.
Considere R = 2,0 cal/mol.K.
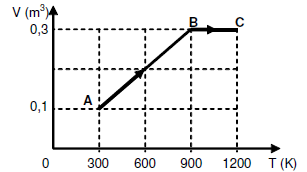
A) 1200 cal
B) 1300 cal
C) 1400 cal
D) 1500 cal
E) 1600 cal
Resolução:
?ABC = ?AB + ?BC
?AB = p.?V = n.R.?T = 1.2,0.(900 - 300) => ?AB = 1200 cal
?BC = 0
Portanto: ?ABC = 1200 cal
Alternativa: A
26. (CEFET-RJ)
Uma amostra de um gás ideal é comprimida lenta e linearmente a partir do volume inicial 2V0 e pressão P0 até o volume final V0, conforme ilustrado no gráfico. Sabendo que a temperatura final do gás é igual à temperatura inicial, a pressão final e o calor trocado pelo gás no processo, valem respectivamente,
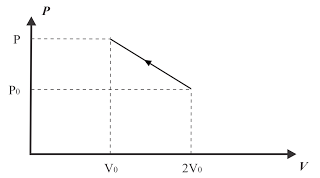 a) (2/3)P0, 3P0V0
a) (2/3)P0, 3P0V0
b) 2P0, (3/2)P0V0
c) 3P0, (2/3)P0V0
d) (3/2)P0V0, 2P0V0
Resolução:
p0.2V0 = p.V0 => p = 2p0
Primeira Lei da Termodinâmica:
?U = Q - ?
Sendo ?U = 0, pois a temperatura final é igual à inicial, vem: Q = ?
27. (UECE)
Uma máquina térmica funciona de modo que n mols de um gás ideal evoluam segundo o ciclo ABCDA, representado na figura.
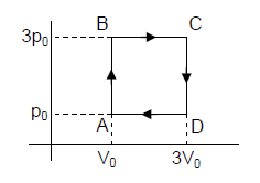 Sabendo-se que a quantidade de calor Q, absorvida da fonte quente, em um ciclo, é 18nRTo, onde To é a temperatura em A, o rendimento dessa máquina é, aproximadamente,
Sabendo-se que a quantidade de calor Q, absorvida da fonte quente, em um ciclo, é 18nRTo, onde To é a temperatura em A, o rendimento dessa máquina é, aproximadamente,
A) 55%
B) 44%
C) 33%
D) 22%
Resolução:
O trabalho é dado numericamente pela área do ciclo:
? = 2p0.2V0 = 4p0V0 = 4nRT0
O rendimento será: ? = ?/Q = 4nRT0/18nRT0 ? 0,22 = 22%
Alternativa: D
28. (UECE)
Uma máquina térmica recebe determinada quantidade de calor e realiza um trabalho útil de 400 J. Considerando que o trabalho da máquina é obtido isobaricamente a uma pressão de 2,0 atm, num pistão que contém gás, determine a variação de volume sofrida pelo gás dentro do pistão. Considere 1,0 atm = 1,0 x 105 N/m2.
A) 10-3 m3
B) 2 x 10-3 m3
C) 8 x 10-3 m3
D) 5 x 10-4 m3
Resolução:
? = p.?V => 400 = 2,0.105.?V => ?V = 2,0.10-3 m3
Alternativa: B
29. (UEMS)
Com relação a 2ª Lei da Termodinâmica, pode-se afirmar que:
I. O calor de um corpo com temperatura T1 passa para outro corpo com temperatura T2 se T2 > T1.
II. Uma maquina térmica operando em ciclos pode retirar calor de uma fonte e convertê-lo integralmente em trabalho.
III. Uma maquina térmica operando em ciclos entre duas fontes térmicas, uma quente e outra fria, converte parte do calor retirado da fonte quente em trabalho e o restante envia para a fonte fria.
Assinale a alternativa que apresenta a(s) afirmativa(s) correta(s).
A) I
B) II
C) III
D) I e II
E) I e III
Resolução:
I) Errada. Espontaneamente o calor passa de um corpo de maior temperatura para outro de menor.
II) Errada. A transformação integral de calor em trabalho é impossível de acordo com a segunda lei da Termodinâmica.
III) Correta, de acordo com a segunda lei da Termodinâmica.
Alternativa: C
30. (URCA)
O ciclo de Carnot apresenta o máximo rendimento para uma máquina térmica operando entre duas temperaturas. Sobre ele podemos afirmar:
I? É formado por duas transformações adiabáticas alternadas com duas transformações isotérmicas, todas reversíveis;
II? A área do ciclo de Carnot é numericamente igual ao trabalho realizado no ciclo;
III? As quantidades de calor trocados com as fontes quente e fria são inversamente proporcionais às respectivas temperaturas absolutas das fontes.
Assinale a opção que indica o(s) item(ns) correto(s):
A) I, II e III;
B) Somente I e III;
C) Somente II e III;
D) Somente I;
E) Somente I e II.
Resolução:
I) Correta. O ciclo de Carnot é formado por duas transformações adiabáticas alternadas com duas transformações isotérmicas, todas reversíveis.
II) Correta. A área do ciclo é numericamente igual ao trabalho realizado no ciclo.
III) Errada. As quantidades de calor trocados com as fontes quente e fria são diretamente proporcionais às respectivas temperaturas absolutas das fontes.
Alternativa: E
- Cursos Do Blog - Termologia, Óptica E Ondas
Refrigerador comum (Fontes: Física-Ciência e Tecnologia e Os fundamentos da Física) 19ª aula Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que...
- Cursos Do Blog - Termologia, Óptica E Ondas
Refrigerador comum (Fontes: Física-Ciência e Tecnologia e Os fundamentos da Física) 19ª aula Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que...
- Cursos Do Blog - Termologia, Óptica E Ondas
19ª aula Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que o gás realiza sobre o meio exterior ou recebe do meio exterior é dado pelo...
- Cursos Do Blog - Termologia, Óptica E Ondas
Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que o gás realiza sobre o meio exterior ou recebe do meio exterior é dado pelo produto da...
- Cursos Do Blog - Termologia, Óptica E Ondas
Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que o gás realiza sobre o meio exterior ou recebe do meio exterior é dado pelo produto da...
Física
Cursos do Blog - Termologia, Óptica e Ondas
RESOLUÇÃO DO SIMULADO
(Questões de 21 a 30)
Borges e Nicolau
21. (UEMS)
Certa quantidade de gás ideal, contida num recipiente de volume 2 litros, tem uma temperatura de 27 ºC, sob uma pressão de 1,5 atm. Essa mesma quantidade de gás, se colocada num recipiente de volume 1 litro, sob uma pressão de 2 atm, terá uma temperatura de:
A) -63 ºC
B) -73 ºC
C) -83 ºC
D) -93 ºC
E) -103 ºC
Resolução:
P1.V1/T1 = P2.V2/T2 => 1,5.2/300 = 2.1/T2 =>
T2 = 200 K => -73 ºC
x
Alternativa: B
22. (UFPB)
Um gás ideal sofre três processos termodinâmicos na seguinte seqüência: dilatação isotérmica, compressão isobárica e transformação isocórica. Esses processos estão representados no diagrama PV (Pressão × Volume) abaixo.

Nessas circunstâncias, o diagrama VT (Volume × Temperatura) correspondente é:



Resolução:
No diagrama V x T, temos:
dilatação isotérmica => segmento de reta paralelo ao eixo V
compressão isobárica => segmento de reta cujo prolongamento passa pela origem (0 K)
transformação isocórica => segmento de reta paralelo ao eixo T
Alternativa: C
23. (UFMA)
De acordo com a primeira Lei da Termodinâmica, a variação da energia interna (?U) igual à diferença entre o calor trocado com o ambiente (Q) e o trabalho realizado no processo termodinâmico (?). Dessa forma, qual o valor de ?U quando um gás ideal passa por transformações do tipo: isotérmica, isobárica, isométrica, adiabática e cíclica?
A) zero, Q - ?, Q, -?, zero
B) Q - ?, Q, zero, -?, zero
C) zero, Q, Q - ?, zero, -?
D) Q, -?, Q - ?, zero, zero
E) -?, Q, zero, Q - ?, zero
x
Resolução:
Transformações:
1) isotérmica: T constante, U constante e ?U = 0
2) isobárica: ?U = Q - ?
3) isométrica: V constante, ? = 0 e ?U = Q
4) adiabática: Q = 0 e ?U = -?
5) cíclica: ?U = 0
Alternativa: A
24. (UNIR-RO)
Dois gases ideais submetidos às pressões p1 = 1 atm e p2 = 2 atm, em equilíbrio térmico, estão confinados em recipientes de volumes V1 = 2 m3 e V2 = 3 m3, respectivamente, ligados por uma válvula inicialmente fechada. Ao se abrir a válvula, os dois gases fluem livremente, sem alterar sua temperatura, ocupando os dois recipientes com a mesma pressão que será:
A) 2,5 atm
B) 3,0 atm
C) 1,5 atm
D) 0,6 atm
E) 1,6 atm
x
Resolução:
O número de mols (n) da mistura dos gases depois de abrir a válvula é igual à soma dos números de mols (n1 + n2) antes de a válvula ser aberta:
n = n1 + n2
pV/RT = p1V1/RT + p2V2/RT
p.(2 + 3) = 1.2 + 2.3
p = 1,6 atm
Alternativa: E
25. (UFPE)
Um mol de um gás ideal, inicialmente à temperatura de 300 K, é submetido ao processo termodinâmico A?B?C mostrado no diagrama V versus T. Determine o trabalho realizado pelo gás, em calorias.
Considere R = 2,0 cal/mol.K.

A) 1200 cal
B) 1300 cal
C) 1400 cal
D) 1500 cal
E) 1600 cal
Resolução:
?ABC = ?AB + ?BC
?AB = p.?V = n.R.?T = 1.2,0.(900 - 300) => ?AB = 1200 cal
?BC = 0
Portanto: ?ABC = 1200 cal
Alternativa: A
26. (CEFET-RJ)
Uma amostra de um gás ideal é comprimida lenta e linearmente a partir do volume inicial 2V0 e pressão P0 até o volume final V0, conforme ilustrado no gráfico. Sabendo que a temperatura final do gás é igual à temperatura inicial, a pressão final e o calor trocado pelo gás no processo, valem respectivamente,

b) 2P0, (3/2)P0V0
c) 3P0, (2/3)P0V0
d) (3/2)P0V0, 2P0V0
Resolução:
p0.2V0 = p.V0 => p = 2p0
Primeira Lei da Termodinâmica:
?U = Q - ?
Sendo ?U = 0, pois a temperatura final é igual à inicial, vem: Q = ?
Mas, numericamente, temos:
I?I = Área do trapézio = [(2p0 + p0)/2].V0 = 3p0V0/2
Portanto, a quantidade de calor que o gás troca é, em módulo, igual a 3p0V0/2
Alternativa: B
27. (UECE)
Uma máquina térmica funciona de modo que n mols de um gás ideal evoluam segundo o ciclo ABCDA, representado na figura.

A) 55%
B) 44%
C) 33%
D) 22%
Resolução:
O trabalho é dado numericamente pela área do ciclo:
? = 2p0.2V0 = 4p0V0 = 4nRT0
O rendimento será: ? = ?/Q = 4nRT0/18nRT0 ? 0,22 = 22%
Alternativa: D
28. (UECE)
Uma máquina térmica recebe determinada quantidade de calor e realiza um trabalho útil de 400 J. Considerando que o trabalho da máquina é obtido isobaricamente a uma pressão de 2,0 atm, num pistão que contém gás, determine a variação de volume sofrida pelo gás dentro do pistão. Considere 1,0 atm = 1,0 x 105 N/m2.
A) 10-3 m3
B) 2 x 10-3 m3
C) 8 x 10-3 m3
D) 5 x 10-4 m3
Resolução:
? = p.?V => 400 = 2,0.105.?V => ?V = 2,0.10-3 m3
Alternativa: B
29. (UEMS)
Com relação a 2ª Lei da Termodinâmica, pode-se afirmar que:
I. O calor de um corpo com temperatura T1 passa para outro corpo com temperatura T2 se T2 > T1.
II. Uma maquina térmica operando em ciclos pode retirar calor de uma fonte e convertê-lo integralmente em trabalho.
III. Uma maquina térmica operando em ciclos entre duas fontes térmicas, uma quente e outra fria, converte parte do calor retirado da fonte quente em trabalho e o restante envia para a fonte fria.
Assinale a alternativa que apresenta a(s) afirmativa(s) correta(s).
A) I
B) II
C) III
D) I e II
E) I e III
Resolução:
I) Errada. Espontaneamente o calor passa de um corpo de maior temperatura para outro de menor.
II) Errada. A transformação integral de calor em trabalho é impossível de acordo com a segunda lei da Termodinâmica.
III) Correta, de acordo com a segunda lei da Termodinâmica.
Alternativa: C
30. (URCA)
O ciclo de Carnot apresenta o máximo rendimento para uma máquina térmica operando entre duas temperaturas. Sobre ele podemos afirmar:
I? É formado por duas transformações adiabáticas alternadas com duas transformações isotérmicas, todas reversíveis;
II? A área do ciclo de Carnot é numericamente igual ao trabalho realizado no ciclo;
III? As quantidades de calor trocados com as fontes quente e fria são inversamente proporcionais às respectivas temperaturas absolutas das fontes.
Assinale a opção que indica o(s) item(ns) correto(s):
A) I, II e III;
B) Somente I e III;
C) Somente II e III;
D) Somente I;
E) Somente I e II.
Resolução:
I) Correta. O ciclo de Carnot é formado por duas transformações adiabáticas alternadas com duas transformações isotérmicas, todas reversíveis.
II) Correta. A área do ciclo é numericamente igual ao trabalho realizado no ciclo.
III) Errada. As quantidades de calor trocados com as fontes quente e fria são diretamente proporcionais às respectivas temperaturas absolutas das fontes.
Alternativa: E
loading...
- Cursos Do Blog - Termologia, Óptica E Ondas
Refrigerador comum (Fontes: Física-Ciência e Tecnologia e Os fundamentos da Física) 19ª aula Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que...
- Cursos Do Blog - Termologia, Óptica E Ondas
Refrigerador comum (Fontes: Física-Ciência e Tecnologia e Os fundamentos da Física) 19ª aula Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que...
- Cursos Do Blog - Termologia, Óptica E Ondas
19ª aula Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que o gás realiza sobre o meio exterior ou recebe do meio exterior é dado pelo...
- Cursos Do Blog - Termologia, Óptica E Ondas
Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que o gás realiza sobre o meio exterior ou recebe do meio exterior é dado pelo produto da...
- Cursos Do Blog - Termologia, Óptica E Ondas
Termodinâmica (IV) Borges e Nicolau Revisando e complementando 1. Transformação isobárica Na transformação isobárica estudamos que o trabalho ? que o gás realiza sobre o meio exterior ou recebe do meio exterior é dado pelo produto da...
