Física
Estudos dos gases (II)
Borges e Nicolau
Equação de Clapeyron
Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de mols (n) do gás.
Assim, podemos escrever: (p.V)/T = R.n, onde R é uma constante de proporcionalidade, igual para todos os gases, denominada constante universal dos gases perfeitos.
Desde modo, resulta:
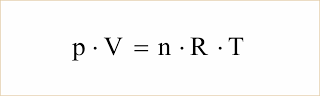
Sendo n = m/M, onde m é a massa do gás e M a massa molar, podemos escrever:
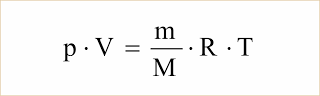
Valores de R
Os valores de R dependem do sistema de unidades utilizado. Temos:
R = 0,082 (atm.L)/(mol.K)
R ? 62,36 (mmHg.L)/(mol.K)
R ? 8,31 J/mol.K
R ? 2,0 cal/mol.K
Equação geral dos gases perfeitos
De p.V/T = R.n, observamos que para um dado número de mols n, ou seja, para uma dada massa m de um gás perfeito, o produto R.n é constante e portanto: p.V/T = constante. Concluímos, então, que se uma dada massa de gás perfeito passa do estado p1. V1, T1 para o estado p2, V2, T2, podemos escrever:
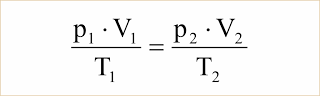
Particularizando para as transformações já estudadas, temos:
a) Transformação isobárica: p1 = p2 => V1/T1 = V2/T2
b) Transformação isocórica: V1 = V2 => p1/T1 = p2/T2
c) Transformação isotérmica: T1 = T2 => p1.V1 = p2.V2
Exercícios básicos
Exercício 1:
Dez mols de um gás perfeito exercem a pressão de 1,0 atm, à temperatura de 0 ºC. Qual é o volume do recipiente que contém o gás?
É dada a constante universal dos gases perfeitos:
R = 0,082 (atm.L)/(mol.K)
Exercício 2:
Um recipiente contém 6,0 mols de um gás perfeito, sob pressão de 4,0 atm e à temperatura ambiente. A pressão externa é constante e igual a 1,0 atm. Um furo é feito no recipiente e parte do gás escapa até que seja atingido o equilíbrio. Qual é o número de mols do gás que permanece no recipiente?
Exercício 3:
Certa massa de gás perfeito ocupa um volume de 5,0 L, sob pressão de 2,0 atm e à temperatura de 300 K. O gás sofre uma determinada transformação ocorrendo mudanças em suas três variáveis de estado. Três estados finais são propostos:
I) 3,0 L; 5,0 atm; 500 K
II) 8.0 L; 2,5 atm; 600 K
III) 6,0 L; 4,0 atm; 450 K
Qual destes estados é possível?
Exercício 4:
A pressão de uma determinada massa de gás perfeito, contida num cilindro provido de êmbolo, triplica e seu volume se reduz à metade. Sejam T1 e T2 as temperaturas inicial e final do gás, medidas em kelvin. Determine a relação T2/T1.
Exercício 5:
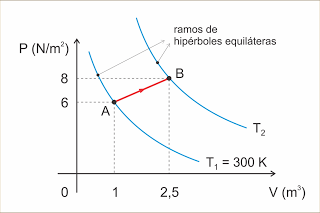
Determinada massa de um gás perfeito sofre a transformação AB indicada no diagrama. Determine a temperatura T2.
- Cursos Do Blog - Termologia, Óptica E Ondas
14ª aula Estudos dos gases (II) Borges e Nicolau Equação de Clapeyron Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de...
- Cursos Do Blog - Termologia, Óptica E Ondas
14ª aula Estudos dos gases (II) Borges e Nicolau Equação de Clapeyron Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de...
- Cursos Do Blog - Termologia, Óptica E Ondas
14ª aula Estudos dos gases (II) Borges e Nicolau Equação de Clapeyron Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de mols...
- Cursos Do Blog - Respostas 17/05
Estudos dos gases (II) Borges e Nicolau Exercício 1: Dez mols de um gás perfeito exercem a pressão de 1,0 atm, à temperatura de 0 ºC. Qual é o volume do recipiente que contém o gás? É dada a constante universal dos gases perfeitos: R = 0,082...
- Gases Perfeitos
Gases Perfeitos Verificam-se a existência de vários gases na natureza (oxigênio, hélio, hidrogênio,...) os gases reais. Por possuírem características moleculares diferentes, muitas vezes possuem comportamentos diferentes. Em determinadas condições...
Física
Cursos do Blog - Termologia, Óptica e Ondas
Estudos dos gases (II)
Borges e Nicolau
Equação de Clapeyron
Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de mols (n) do gás.
Assim, podemos escrever: (p.V)/T = R.n, onde R é uma constante de proporcionalidade, igual para todos os gases, denominada constante universal dos gases perfeitos.
Desde modo, resulta:
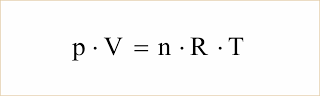
Equação de Clapeyron
Sendo n = m/M, onde m é a massa do gás e M a massa molar, podemos escrever:
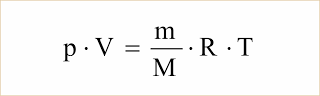
Valores de R
Os valores de R dependem do sistema de unidades utilizado. Temos:
R = 0,082 (atm.L)/(mol.K)
R ? 62,36 (mmHg.L)/(mol.K)
R ? 8,31 J/mol.K
R ? 2,0 cal/mol.K
Equação geral dos gases perfeitos
De p.V/T = R.n, observamos que para um dado número de mols n, ou seja, para uma dada massa m de um gás perfeito, o produto R.n é constante e portanto: p.V/T = constante. Concluímos, então, que se uma dada massa de gás perfeito passa do estado p1. V1, T1 para o estado p2, V2, T2, podemos escrever:
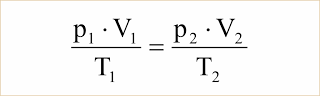
Particularizando para as transformações já estudadas, temos:
a) Transformação isobárica: p1 = p2 => V1/T1 = V2/T2
b) Transformação isocórica: V1 = V2 => p1/T1 = p2/T2
c) Transformação isotérmica: T1 = T2 => p1.V1 = p2.V2
Exercícios básicos
Exercício 1:
Dez mols de um gás perfeito exercem a pressão de 1,0 atm, à temperatura de 0 ºC. Qual é o volume do recipiente que contém o gás?
É dada a constante universal dos gases perfeitos:
R = 0,082 (atm.L)/(mol.K)
Exercício 2:
Um recipiente contém 6,0 mols de um gás perfeito, sob pressão de 4,0 atm e à temperatura ambiente. A pressão externa é constante e igual a 1,0 atm. Um furo é feito no recipiente e parte do gás escapa até que seja atingido o equilíbrio. Qual é o número de mols do gás que permanece no recipiente?
Exercício 3:
Certa massa de gás perfeito ocupa um volume de 5,0 L, sob pressão de 2,0 atm e à temperatura de 300 K. O gás sofre uma determinada transformação ocorrendo mudanças em suas três variáveis de estado. Três estados finais são propostos:
I) 3,0 L; 5,0 atm; 500 K
II) 8.0 L; 2,5 atm; 600 K
III) 6,0 L; 4,0 atm; 450 K
Qual destes estados é possível?
Exercício 4:
A pressão de uma determinada massa de gás perfeito, contida num cilindro provido de êmbolo, triplica e seu volume se reduz à metade. Sejam T1 e T2 as temperaturas inicial e final do gás, medidas em kelvin. Determine a relação T2/T1.
Exercício 5:
Determinada massa de um gás perfeito sofre a transformação AB indicada no diagrama. Determine a temperatura T2.

Clique para ampliar
loading...
- Cursos Do Blog - Termologia, Óptica E Ondas
14ª aula Estudos dos gases (II) Borges e Nicolau Equação de Clapeyron Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de...
- Cursos Do Blog - Termologia, Óptica E Ondas
14ª aula Estudos dos gases (II) Borges e Nicolau Equação de Clapeyron Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de...
- Cursos Do Blog - Termologia, Óptica E Ondas
14ª aula Estudos dos gases (II) Borges e Nicolau Equação de Clapeyron Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de mols...
- Cursos Do Blog - Respostas 17/05
Estudos dos gases (II) Borges e Nicolau Exercício 1: Dez mols de um gás perfeito exercem a pressão de 1,0 atm, à temperatura de 0 ºC. Qual é o volume do recipiente que contém o gás? É dada a constante universal dos gases perfeitos: R = 0,082...
- Gases Perfeitos
Gases Perfeitos Verificam-se a existência de vários gases na natureza (oxigênio, hélio, hidrogênio,...) os gases reais. Por possuírem características moleculares diferentes, muitas vezes possuem comportamentos diferentes. Em determinadas condições...
