Física
14ª aula
Estudos dos gases (II)
Borges e Nicolau
Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de mols (n) do gás.
Assim, podemos escrever: (p.V)/T = R.n, onde R é uma constante de proporcionalidade, igual para todos os gases, denominada constante universal dos gases perfeitos.
Desde modo, resulta:
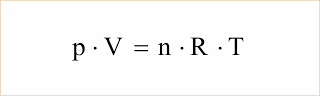
Sendo n = m/M, onde m é a massa do gás e M a massa molar, podemos escrever:
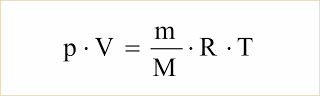
Valores de R
Os valores de R dependem do sistema de unidades utilizado. Temos:
R = 0,082 (atm.L)/(mol.K)
R ? 62,36 (mmHg.L)/(mol.K)
R ? 8,31 J/mol.K
R ? 2,0 cal/mol.K
De p.V/T = R.n, observamos que para um dado número de mols n, ou seja, para uma dada massa m de um gás perfeito, o produto R.n é constante e portanto: p.V/T = constante. Concluímos, então, que se uma dada massa de gás perfeito passa do estado p1. V1, T1 para o estado p2, V2, T2, podemos escrever:
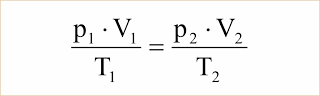
Particularizando para as transformações já estudadas, temos:
a) Transformação isobárica: p1 = p2 => V1/T1 = V2/T2
b) Transformação isocórica: V1 = V2 => p1/T1 = p2/T2
c) Transformação isotérmica: T1 = T2 => p1.V1 = p2.V2
Exercícios básicos
Exercício 1:
Dez mols de um gás perfeito exercem a pressão de 1,0 atm, à temperatura de 0 ºC. Qual é o volume do recipiente que contém o gás?
É dada a constante universal dos gases perfeitos:
R = 0,082 (atm.L)/(mol.K)
Resolução: clique aqui
Exercício 2:
Um recipiente contém 6,0 mols de um gás perfeito, sob pressão de 4,0 atm e à temperatura ambiente. A pressão externa é constante e igual a 1,0 atm. Um furo é feito no recipiente e parte do gás escapa até que seja atingido o equilíbrio. Qual é o número de mols do gás que permanece no recipiente?
Resolução: clique aqui
Exercício 3:
Certa massa de gás perfeito ocupa um volume de 5,0 L, sob pressão de 2,0 atm e à temperatura de 300 K. O gás sofre uma determinada transformação ocorrendo mudanças em suas três variáveis de estado. Três estados finais são propostos:
I) 3,0 L; 5,0 atm; 500 K
II) 8.0 L; 2,5 atm; 600 K
III) 6,0 L; 4,0 atm; 450 K
Qual destes estados é possível?
Resolução: clique aqui
Exercício 4:
A pressão de uma determinada massa de gás perfeito, contida num cilindro provido de êmbolo, triplica e seu volume se reduz à metade. Sejam T1 e T2 as temperaturas inicial e final do gás, medidas em kelvin. Determine a relação T2/T1.
Resolução: clique aqui
Exercício 5:
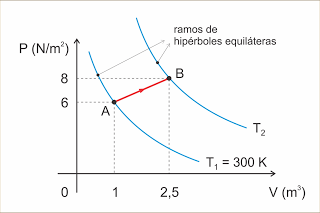
Determinada massa de um gás perfeito sofre a transformação AB indicada no diagrama. Determine a temperatura T2.
Exercícios de revisão
Revisão/Ex 1:
(FUVEST-SP)
Um bujão de gás de cozinha contém 13 kg de gás liquefeito, a alta pressão. Um mol desse gás tem massa de, aproximadamente, 52 g. Se todo o conteúdo do bujão fosse utilizado para encher um balão, à pressão atmosférica e à temperatura de 300 K, o volume final do balão seria aproximadamente de:
a) 13 m3
b) 6,2 m3
c) 3,1 m3
d) 0,98 m3
e) 0,27 m3
Dados: R = 8,3 J/(mol.K) ou
Dados: R = 0,082 atm.L/(mol.K)
Dados: Patmosférica = 1 atm = 1.105 Pa
Dados: 1 Pa = 1 N/m2
Dados: 1 m3 = 1000 L
Resolução: clique aqui
Revisão/Ex 2:
(VUNESP)
Um frasco para medicamento com capacidade de 50 mL, contém 35 mL de remédio, sendo o volume restante ocupado por ar. Uma enfermeira encaixa uma seringa nesse frasco e retira 10 mL do medicamento, sem que tenha entrado ou saído ar do frasco. Considere que durante o processo a temperatura do sistema tenha permanecido constante e que o ar dentro do frasco possa ser considerado um gás ideal.
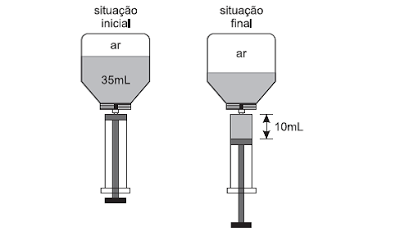
Na situação final em que a seringa com o medicamento ainda estava encaixada no frasco, a retirada dessa dose fez com que a pressão do ar dentro do frasco passasse a ser, em relação à pressão inicial,
a) 60% maior.
b) 40% maior.
c) 60% menor.
d) 40% menor.
e) 25% menor.
Resolução: clique aqui
Revisão/Ex 3:
(URCA)
Uma certa quantidade de gás ideal está encerrado dentro de um recipiente cilíndrico. Comprime-se isotermicamente o gás à temperatura de 127ºC, até a pressão de 2 atm. Em seguida, libera-se, a metade do gás do recipiente. Depois verifica-se que, mantendo o gás a volume constante, a nova temperatura de equilíbrio passa a ser de 7ºC. Calcule a nova pressão, em atm, do gás no recipiente.
a) 0,5
b) 0,7
c) 0,9
d) 1,0
e) 1,3
Resolução: clique aqui
Revisão/Ex 4:
(IJSO-International Junior Science Olympiad)
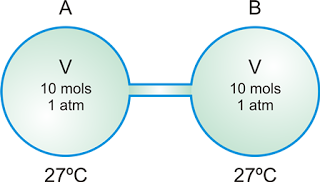
Dois recipientes, A e B, indilatáveis e de mesmo volume V estão conectados por um tubo cilíndrico de volume desprezível. Um gás perfeito ocupa os dois recipientes, exercendo uma pressão de 1,0 atm. A temperatura é de 27ºC e em cada recipiente há 10 mols do gás.
O recipiente B permanece à temperatura de 27ºC, enquanto que o A é aquecido e mantido a 227ºC. Em consequência, x mols de gás passam do recipiente A para o recipiente B, até que as pressões nos dois recipientes se tornem iguais a um determinado valor p.
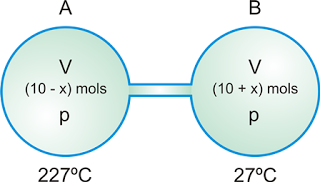
Os valores de x e p são, respectivamente, iguais a:
a) 2,5 mols e 1,25 atm
b) 5,0 mols e 2,5 atm
c) 1,25 mol e 2,5 atm
d) 10 mols e 2,0 atm
e) 0 e 1,0 atm
Resolução: clique aqui
Revisão/Ex 5:
(UFMG)
Um reservatório fechado contém certa quantidade de hélio gasoso à pressão pi.
Num primeiro processo, esse gás é aquecido, lentamente, de uma temperatura inicial Ti até uma temperatura TF.
Num segundo processo, um pequeno orifício é aberto na parede do reservatório e, por ele, muito lentamente, deixa-se escapar um quarto do conteúdo inicial do gás. Durante esse processo, o reservatório é mantido à temperatura TF.
Considerando essas informações,
1. ESBOCE, no quadro abaixo, o diagrama da pressão em função da temperatura do gás nos dois processos descritos.
JUSTIFIQUE sua resposta.
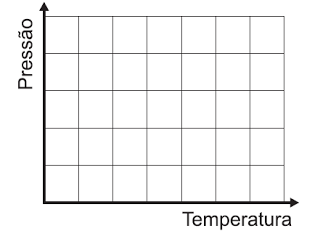
2. Considere que pi = 1,0x105 N/m2 e que as temperaturas são
Ti = 27 ºC e TF = 87 ºC.
CALCULE o valor da pressão do gás no interior do reservatório, ao final do segundo processo.
Resolução: clique aqui
- Cursos Do Blog - Termologia, Óptica E Ondas
14ª aula Estudos dos gases (II) Borges e Nicolau Equação de Clapeyron Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de...
- Cursos Do Blog - Termologia, Óptica E Ondas
13ª aula Estudo dos gases (I) Borges e Nicolau Gás ideal ou gás perfeito No estudo do comportamento de um gás, consideramos o seguinte modelo: ? as moléculas do gás movimentam-se caoticamente; ? os choques entre as moléculas e contra as paredes...
- Cursos Do Blog - Termologia, Óptica E Ondas
Estudos dos gases (II) Borges e Nicolau Equação de Clapeyron Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de mols (n) do...
- Cursos Do Blog - Respostas 17/05
Estudos dos gases (II) Borges e Nicolau Exercício 1: Dez mols de um gás perfeito exercem a pressão de 1,0 atm, à temperatura de 0 ºC. Qual é o volume do recipiente que contém o gás? É dada a constante universal dos gases perfeitos: R = 0,082...
- Cursos Do Blog - Termologia, Óptica E Ondas
Estudos dos gases (II) Borges e Nicolau Equação de Clapeyron Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de mols (n) do...
Física
Cursos do Blog - Termologia, Óptica e Ondas

14ª aula
Estudos dos gases (II)
Borges e Nicolau
Equação de Clapeyron
Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de mols (n) do gás.
Assim, podemos escrever: (p.V)/T = R.n, onde R é uma constante de proporcionalidade, igual para todos os gases, denominada constante universal dos gases perfeitos.
Desde modo, resulta:
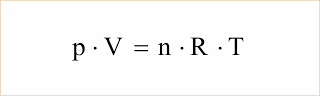
Equação de Clapeyron
Sendo n = m/M, onde m é a massa do gás e M a massa molar, podemos escrever:
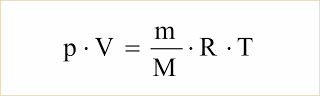
Valores de R
Os valores de R dependem do sistema de unidades utilizado. Temos:
R = 0,082 (atm.L)/(mol.K)
R ? 62,36 (mmHg.L)/(mol.K)
R ? 8,31 J/mol.K
R ? 2,0 cal/mol.K
Equação geral dos gases perfeitos
De p.V/T = R.n, observamos que para um dado número de mols n, ou seja, para uma dada massa m de um gás perfeito, o produto R.n é constante e portanto: p.V/T = constante. Concluímos, então, que se uma dada massa de gás perfeito passa do estado p1. V1, T1 para o estado p2, V2, T2, podemos escrever:
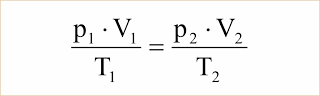
Particularizando para as transformações já estudadas, temos:
a) Transformação isobárica: p1 = p2 => V1/T1 = V2/T2
b) Transformação isocórica: V1 = V2 => p1/T1 = p2/T2
c) Transformação isotérmica: T1 = T2 => p1.V1 = p2.V2
Exercícios básicos
Exercício 1:
Dez mols de um gás perfeito exercem a pressão de 1,0 atm, à temperatura de 0 ºC. Qual é o volume do recipiente que contém o gás?
É dada a constante universal dos gases perfeitos:
R = 0,082 (atm.L)/(mol.K)
Resolução: clique aqui
Exercício 2:
Um recipiente contém 6,0 mols de um gás perfeito, sob pressão de 4,0 atm e à temperatura ambiente. A pressão externa é constante e igual a 1,0 atm. Um furo é feito no recipiente e parte do gás escapa até que seja atingido o equilíbrio. Qual é o número de mols do gás que permanece no recipiente?
Resolução: clique aqui
Exercício 3:
Certa massa de gás perfeito ocupa um volume de 5,0 L, sob pressão de 2,0 atm e à temperatura de 300 K. O gás sofre uma determinada transformação ocorrendo mudanças em suas três variáveis de estado. Três estados finais são propostos:
I) 3,0 L; 5,0 atm; 500 K
II) 8.0 L; 2,5 atm; 600 K
III) 6,0 L; 4,0 atm; 450 K
Qual destes estados é possível?
Resolução: clique aqui
Exercício 4:
A pressão de uma determinada massa de gás perfeito, contida num cilindro provido de êmbolo, triplica e seu volume se reduz à metade. Sejam T1 e T2 as temperaturas inicial e final do gás, medidas em kelvin. Determine a relação T2/T1.
Resolução: clique aqui
Exercício 5:
Determinada massa de um gás perfeito sofre a transformação AB indicada no diagrama. Determine a temperatura T2.

Clique para ampliar
Resolução: clique aqui
Exercícios de revisão
Revisão/Ex 1:
(FUVEST-SP)
Um bujão de gás de cozinha contém 13 kg de gás liquefeito, a alta pressão. Um mol desse gás tem massa de, aproximadamente, 52 g. Se todo o conteúdo do bujão fosse utilizado para encher um balão, à pressão atmosférica e à temperatura de 300 K, o volume final do balão seria aproximadamente de:
a) 13 m3
b) 6,2 m3
c) 3,1 m3
d) 0,98 m3
e) 0,27 m3
Dados: R = 8,3 J/(mol.K) ou
Dados: R = 0,082 atm.L/(mol.K)
Dados: Patmosférica = 1 atm = 1.105 Pa
Dados: 1 Pa = 1 N/m2
Dados: 1 m3 = 1000 L
Resolução: clique aqui
Revisão/Ex 2:
(VUNESP)
Um frasco para medicamento com capacidade de 50 mL, contém 35 mL de remédio, sendo o volume restante ocupado por ar. Uma enfermeira encaixa uma seringa nesse frasco e retira 10 mL do medicamento, sem que tenha entrado ou saído ar do frasco. Considere que durante o processo a temperatura do sistema tenha permanecido constante e que o ar dentro do frasco possa ser considerado um gás ideal.

Na situação final em que a seringa com o medicamento ainda estava encaixada no frasco, a retirada dessa dose fez com que a pressão do ar dentro do frasco passasse a ser, em relação à pressão inicial,
a) 60% maior.
b) 40% maior.
c) 60% menor.
d) 40% menor.
e) 25% menor.
Resolução: clique aqui
Revisão/Ex 3:
(URCA)
Uma certa quantidade de gás ideal está encerrado dentro de um recipiente cilíndrico. Comprime-se isotermicamente o gás à temperatura de 127ºC, até a pressão de 2 atm. Em seguida, libera-se, a metade do gás do recipiente. Depois verifica-se que, mantendo o gás a volume constante, a nova temperatura de equilíbrio passa a ser de 7ºC. Calcule a nova pressão, em atm, do gás no recipiente.
a) 0,5
b) 0,7
c) 0,9
d) 1,0
e) 1,3
Resolução: clique aqui
Revisão/Ex 4:
(IJSO-International Junior Science Olympiad)
Dois recipientes, A e B, indilatáveis e de mesmo volume V estão conectados por um tubo cilíndrico de volume desprezível. Um gás perfeito ocupa os dois recipientes, exercendo uma pressão de 1,0 atm. A temperatura é de 27ºC e em cada recipiente há 10 mols do gás.

O recipiente B permanece à temperatura de 27ºC, enquanto que o A é aquecido e mantido a 227ºC. Em consequência, x mols de gás passam do recipiente A para o recipiente B, até que as pressões nos dois recipientes se tornem iguais a um determinado valor p.

Os valores de x e p são, respectivamente, iguais a:
a) 2,5 mols e 1,25 atm
b) 5,0 mols e 2,5 atm
c) 1,25 mol e 2,5 atm
d) 10 mols e 2,0 atm
e) 0 e 1,0 atm
Resolução: clique aqui
Revisão/Ex 5:
(UFMG)
Um reservatório fechado contém certa quantidade de hélio gasoso à pressão pi.
Num primeiro processo, esse gás é aquecido, lentamente, de uma temperatura inicial Ti até uma temperatura TF.
Num segundo processo, um pequeno orifício é aberto na parede do reservatório e, por ele, muito lentamente, deixa-se escapar um quarto do conteúdo inicial do gás. Durante esse processo, o reservatório é mantido à temperatura TF.
Considerando essas informações,
1. ESBOCE, no quadro abaixo, o diagrama da pressão em função da temperatura do gás nos dois processos descritos.
JUSTIFIQUE sua resposta.

2. Considere que pi = 1,0x105 N/m2 e que as temperaturas são
Ti = 27 ºC e TF = 87 ºC.
CALCULE o valor da pressão do gás no interior do reservatório, ao final do segundo processo.
Resolução: clique aqui
loading...
- Cursos Do Blog - Termologia, Óptica E Ondas
14ª aula Estudos dos gases (II) Borges e Nicolau Equação de Clapeyron Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de...
- Cursos Do Blog - Termologia, Óptica E Ondas
13ª aula Estudo dos gases (I) Borges e Nicolau Gás ideal ou gás perfeito No estudo do comportamento de um gás, consideramos o seguinte modelo: ? as moléculas do gás movimentam-se caoticamente; ? os choques entre as moléculas e contra as paredes...
- Cursos Do Blog - Termologia, Óptica E Ondas
Estudos dos gases (II) Borges e Nicolau Equação de Clapeyron Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de mols (n) do...
- Cursos Do Blog - Respostas 17/05
Estudos dos gases (II) Borges e Nicolau Exercício 1: Dez mols de um gás perfeito exercem a pressão de 1,0 atm, à temperatura de 0 ºC. Qual é o volume do recipiente que contém o gás? É dada a constante universal dos gases perfeitos: R = 0,082...
- Cursos Do Blog - Termologia, Óptica E Ondas
Estudos dos gases (II) Borges e Nicolau Equação de Clapeyron Sejam p, V e T as variáveis de estado de um gás perfeito. O físico francês Paul-Émile Clapeyron verificou que o quociente (p.V)/T é diretamente proporcional ao número de mols (n) do...
