Física
38ª aula
O átomo de Bohr
Borges e Nicolau
Introdução:
A partir de alguns experimentos, Ernest Rutherford, no início do século XX, propôs um modelo para o átomo. Uma nuvem de elétrons carregados negativamente circundando o denso núcleo, carregado positivamente.
Uma concepção planetária onde o núcleo seria o Sol e os elétrons, girando em órbita do núcleo, os planetas.
Um problema teórico colocou em dúvida esse modelo. Estando carregado eletricamente e acelerado (aceleração centrípeta) o elétron deveria emitir energia na forma de ondas eletromagnéticas. Com isso acabaria aproximando-se do núcleo até chocar-se com ele.
Embora previsto teoricamente o colapso não acontece o que fez com que o físico dinamarquês Niels Bohr elaborasse uma teoria para solucionar o problema atômico.
A proposta:
Ao criar seu modelo atômico Bohr utilizou a idéia de Planck, segundo a qual a energia não seria emitida continuamente, mas em pequenos ?pacotes?, cada um dos quais denominados quantum. Existiriam níveis estáveis de energia denominados estados estacionários nos quais os elétrons não emitiriam radiação.
A passagem do elétron de um estado estacionário para outro é possível mediante a absorção ou liberação de energia pelo átomo. A energia do fóton absorvido ou liberado corresponde à diferença entre as energias dos níveis envolvidos. Ao passar de um estado estacionário de energia E para outro de energia E?, considerando E?x>xE, teremos:


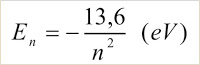
Dados:
Constante de Planck h = 4,14.10-15 eV.s
Velocidade de propagação da luz c = 3,0.108 m/s
Exercícios de Revisão
Revisão/Ex 1:
(ITA?SP)
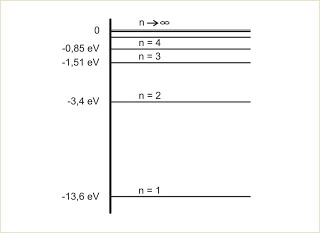
O diagrama mostra os níveis de energia (n) de um elétron em um certo átomo. Qual das transições mostradas na figura representa a emissão de um fóton com o menor comprimento de onda?
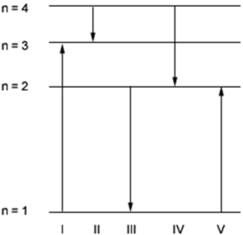
a) I b) II c) III d) IV e) V
Resolução: clique aqui
Revisão/Ex 2:
(UFPE)
De acordo com o modelo de Bohr, os níveis de energia do átomo de hidrogênio são dados por En = -13,6/n2, em eV. Qual a energia, em eV, de um fóton emitido quando o átomo efetua uma transição entre os estados com n = 2 e n = 1?
a) 13,6
b) 10,2
c) 5,6
d) 3,4
e) 1,6
Resolução: clique aqui
Revisão/Ex 3:
(AFA-SP)
O elétron do átomo de hidrogênio, ao passar do primeiro estado estacionário excitado, n = 2 para o estado fundamental n = 1, emite um fóton.
Tendo em vista o diagrama da figura abaixo, que apresenta, de maneira aproximada, os comprimentos de onda das diversas radiações, componentes do espectro eletromagnético, pode-se concluir que o comprimento de onda desse fóton emitido corresponde a uma radiação na região do(s)

a) raios gama
b) raios X
c) ultravioleta
d) infravermelho
Resolução: clique aqui
- Cursos Do Blog - Eletricidade
Três possíveis saltos quânticos de um elétron no átomo de hidrogênio 38ª aula O átomo de Bohr Borges e Nicolau Introdução: A partir de alguns experimentos, Ernest Rutherford, no início do século XX, propôs um modelo para o átomo. Uma...
- Cursos Do Blog - Eletricidade
Três possíveis saltos quânticos de um elétron no átomo de hidrogênio 38ª aula O átomo de Bohr Borges e Nicolau Introdução: A partir de alguns experimentos, Ernest Rutherford, no início do século XX, propôs um modelo para o átomo. Uma...
- Cursos Do Blog - Eletricidade
O átomo de Bohr Borges e Nicolau Introdução: A partir de alguns experimentos, Ernest Rutherford, no início do século XX, propôs um modelo para o átomo. Uma nuvem de elétrons carregados negativamente circundando o denso núcleo, carregado...
- Especial De Sábado
Ganhadores do Premio Nobel de Física Borges e Nicolaux1922Niels Henrik David Bohr, "pelo estudo da estrutura dos átomos e da radiação por eles emitida". iNiels Henrik David Bohr (1885-1962), físico dinamarquêsxNiels Bohr, ao criar seu modelo atômico,...
- Cursos Do Blog - Respostas
O átomo de Bohr Borges e Nicolau Exercício 1O elétron do átomo de hidrogênio ao absorver um fóton passa do estado fundamental (n=1) para o primeiro estado estacionário excitado (n=2). Sendo h = 4,14.10-15 eV.s a constante de Planck, determine:...
Física
Cursos do Blog - Eletricidade

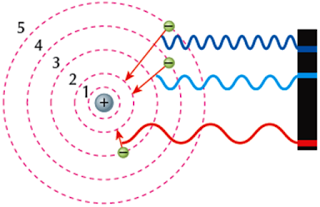
Três possíveis saltos quânticos de um elétron no átomo de hidrogênio
38ª aula
O átomo de Bohr
Borges e Nicolau
Introdução:
A partir de alguns experimentos, Ernest Rutherford, no início do século XX, propôs um modelo para o átomo. Uma nuvem de elétrons carregados negativamente circundando o denso núcleo, carregado positivamente.
Uma concepção planetária onde o núcleo seria o Sol e os elétrons, girando em órbita do núcleo, os planetas.
Um problema teórico colocou em dúvida esse modelo. Estando carregado eletricamente e acelerado (aceleração centrípeta) o elétron deveria emitir energia na forma de ondas eletromagnéticas. Com isso acabaria aproximando-se do núcleo até chocar-se com ele.
Embora previsto teoricamente o colapso não acontece o que fez com que o físico dinamarquês Niels Bohr elaborasse uma teoria para solucionar o problema atômico.
A proposta:
Ao criar seu modelo atômico Bohr utilizou a idéia de Planck, segundo a qual a energia não seria emitida continuamente, mas em pequenos ?pacotes?, cada um dos quais denominados quantum. Existiriam níveis estáveis de energia denominados estados estacionários nos quais os elétrons não emitiriam radiação.
A passagem do elétron de um estado estacionário para outro é possível mediante a absorção ou liberação de energia pelo átomo. A energia do fóton absorvido ou liberado corresponde à diferença entre as energias dos níveis envolvidos. Ao passar de um estado estacionário de energia E para outro de energia E?, considerando E?x>xE, teremos:

onde h é a constante de Planck e f a frequência do fóton absorvido.
Os raios das órbitas permitidas para o átomo de hidrogênio são dadas por:

(n = 1, 2, 3, 4,...)
onde rB = 0,53 Å é denominado raio de Bohr e corresponde ao menor raio, relativo ao estado estacionário fundamental (n = 1).
A energia mecânica total En do elétron no enésimo estado estacionário, para o átomo de hidrogênio é, em elétron-volt, dada por:
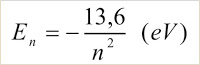
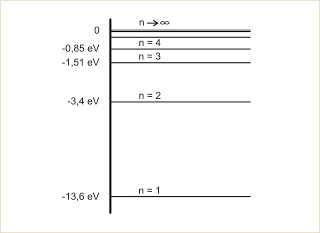
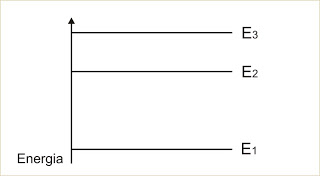
Na figura representamos os níveis de energia de um elétron num átomo de hidrogênio:

Clique para ampliar
Exercícios básicos
Exercício 1:
O elétron do átomo de hidrogênio ao absorver um fóton passa do estado fundamental (n = 1) para o primeiro estado estacionário excitado (n = 2).
Sendo h = 4,14.10-15 eV.s a constante de Planck, determine:
a) a energia absorvida nessa transição;
b) a frequência do fóton absorvido.
Resolução: clique aqui
Exercício 2:
A figura abaixo mostra os níveis de energia do átomo de hidrogênio. Na transição do nível 4 para o nível 1, determine a frequência e o comprimento de onda do fóton emitido.
Dados:
Constante de Planck h = 4,14.10-15 eV.s
Velocidade de propagação da luz c = 3,0.108 m/s

Clique para ampliar
Resolução: clique aqui
Exercício 3:
(UFMG) A figura mostra, esquematicamente, os níveis de energia permitidos para elétrons de um certo elemento químico. Quando esse elemento emite radiação, são observados três comprimentos de onda diferentes, ?a, ?b, ?c.

Clique para ampliar
a) com base na figura, explique a origem da radiação correspondente aos comprimentos de onda ?a, ?b e ?c.
b) considere que ?a < ?b < ?c. Sendo h a constante de Planck e c a velocidade da luz, determine uma expressão para o comprimento de onda ?a.
Resolução: clique aqui
Revisão/Ex 1:
(ITA?SP)
O diagrama mostra os níveis de energia (n) de um elétron em um certo átomo. Qual das transições mostradas na figura representa a emissão de um fóton com o menor comprimento de onda?

a) I b) II c) III d) IV e) V
Resolução: clique aqui
Revisão/Ex 2:
(UFPE)
De acordo com o modelo de Bohr, os níveis de energia do átomo de hidrogênio são dados por En = -13,6/n2, em eV. Qual a energia, em eV, de um fóton emitido quando o átomo efetua uma transição entre os estados com n = 2 e n = 1?
a) 13,6
b) 10,2
c) 5,6
d) 3,4
e) 1,6
Resolução: clique aqui
Revisão/Ex 3:
(AFA-SP)
O elétron do átomo de hidrogênio, ao passar do primeiro estado estacionário excitado, n = 2 para o estado fundamental n = 1, emite um fóton.
Tendo em vista o diagrama da figura abaixo, que apresenta, de maneira aproximada, os comprimentos de onda das diversas radiações, componentes do espectro eletromagnético, pode-se concluir que o comprimento de onda desse fóton emitido corresponde a uma radiação na região do(s)

a) raios gama
b) raios X
c) ultravioleta
d) infravermelho
Resolução: clique aqui
loading...
- Cursos Do Blog - Eletricidade
Três possíveis saltos quânticos de um elétron no átomo de hidrogênio 38ª aula O átomo de Bohr Borges e Nicolau Introdução: A partir de alguns experimentos, Ernest Rutherford, no início do século XX, propôs um modelo para o átomo. Uma...
- Cursos Do Blog - Eletricidade
Três possíveis saltos quânticos de um elétron no átomo de hidrogênio 38ª aula O átomo de Bohr Borges e Nicolau Introdução: A partir de alguns experimentos, Ernest Rutherford, no início do século XX, propôs um modelo para o átomo. Uma...
- Cursos Do Blog - Eletricidade
O átomo de Bohr Borges e Nicolau Introdução: A partir de alguns experimentos, Ernest Rutherford, no início do século XX, propôs um modelo para o átomo. Uma nuvem de elétrons carregados negativamente circundando o denso núcleo, carregado...
- Especial De Sábado
Ganhadores do Premio Nobel de Física Borges e Nicolaux1922Niels Henrik David Bohr, "pelo estudo da estrutura dos átomos e da radiação por eles emitida". iNiels Henrik David Bohr (1885-1962), físico dinamarquêsxNiels Bohr, ao criar seu modelo atômico,...
- Cursos Do Blog - Respostas
O átomo de Bohr Borges e Nicolau Exercício 1O elétron do átomo de hidrogênio ao absorver um fóton passa do estado fundamental (n=1) para o primeiro estado estacionário excitado (n=2). Sendo h = 4,14.10-15 eV.s a constante de Planck, determine:...
